Lægemiddelopdagelse:Første rationelle strategi for at finde molekylære limnedbrydere
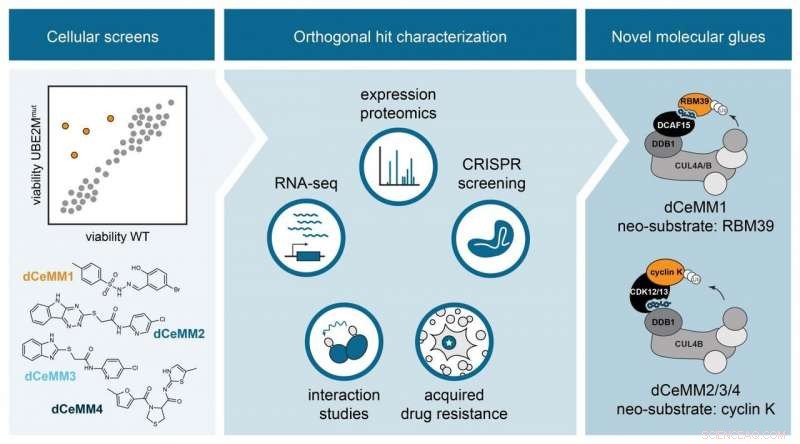
Cellular levedygtighedsskærme nominerede potentielle molekylære lim. Ortogonal undersøgelse af de førende molekyler (dCeMM1/2/3/4) muliggjorde karakterisering af nye molekylære limnedbrydere, der rekrutterer to forskellige E3-ligaser til at fremkalde nedbrydning af proteinerne RBM39 og cyclin K. Kredit:Cristina Mayor-Ruiz/CeMM
På trods af enorme bestræbelser på at fremme traditionelle farmakologiske metoder, mere end tre fjerdedele af alle humane proteiner forbliver uden for rækkevidde af terapeutisk udvikling. Målrettet proteinnedbrydning (TPD) er en ny tilgang, der kunne overvinde denne og andre begrænsninger, og repræsenterer således en lovende terapeutisk strategi. TPD er baseret på små molekyler, generelt kaldet 'nedbrydere, 'som kan eliminere sygdomsfremkaldende proteiner ved at forårsage deres destabilisering. Mekanisk, disse nedbrydende lægemidler genanvendes det cellulære proteinkvalitetskontrolsystem, tilpasse det til at genkende og eliminere skadelige proteiner. I detaljer, de omdirigerer medlemmer af proteinfamilien af E3 ubiquitin-ligaser (E3'er) mod det sygdomsfremkaldende målprotein. Dette fører til en "molekylær øremærkning" af det skadelige protein via en proces kaldet 'ubiquitination'. Efterfølgende, det ubiquitinerede protein genkendes og nedbrydes af den molekylære maskine kaldet proteasomet, som fungerer som det mobile affaldsbortskaffelsessystem.
I dette studie, CeMM -forskere vendte deres fokus til en delmængde af nedbrydere kaldet 'molekylære limnedbrydere'. Denne klasse af tilsyneladende sjældne små molekyler, der har vist sig at forårsage nedbrydning af målproteiner, der ikke kunne blokeres via traditionel farmakologi. Følgelig, disse proteiner var blevet betegnet som 'utilbørlige'. De bedst karakteriserede eksempler er de klinisk godkendte thalidomidanaloger, effektiv til behandling af forskellige blodkræftformer. Desværre, opdagelsen af de få beskrevne molekylære limnedbrydere har historisk set været en proces, der helt er drevet af serendipitet, og der fandtes ingen rationelle opdagelsesstrategier.
For at overvinde denne begrænsning, Georg Wintters gruppe på CeMM satte sig for at innovere en skalerbar strategi mod opdagelse af nye molekylære limnedbrydere via fænotypisk kemisk screening. Til denne ende, første forfatter og CeMM postdoktor Cristina Mayor-Ruiz og kolleger konstruerede cellulære systemer, der var stærkt nedsat i E3-aktivitet. Differential levedygtighed mellem disse modeller og E3-dygtige celler blev brugt til at identificere forbindelser, der er afhængige af aktive E3'er, og derfor, potentielle molekylære limnedbrydere. Forskere integrerede funktionel genomik med strategier for proteomik og lægemiddelinteraktion, at karakterisere de mest lovende forbindelser. De validerede tilgangen ved at opdage en ny RBM39 molekylær limdegrader, strukturelt ligner andre tidligere beskrevet. Vigtigere, de opdagede et sæt nye molekylære lim, der fremkalder nedbrydning af proteinet cyclin K, kendt for at være afgørende for mange forskellige kræftformer. Interessant nok, disse nye cyclin K -nedbrydere fungerer via en hidtil uset molekylær virkningsmekanisme, der involverer E3 CUL4B:DDB1, og som aldrig er blevet undersøgt terapeutisk før.
Dette studie, udført i tæt samarbejde med CeMM PI Stefan Kubicek, giver således den første ramme mod opdagelsen af molekylære limnedbrydere, der kan stærkt skaleres, men også stærkt diversificeret. "Jeg tror virkelig, at vi kun kradser over overfladen af muligheder. Denne undersøgelse er kapitel et af mange kapitler, vi skal følge. Vi vil se en revolution i måden, forskere opfatter og udfører terapeutiske strategier for tidligere uhelbredelige sygdomme ved at udforme limnedbryderstrategier, der vil gøre dem i stand til at eliminere terapeutiske mål, der ikke kunne udforskes med traditionelle farmakologiske fremgangsmåder ", siger CeMM PI og sidste forfatter af undersøgelsen Georg Winter.
 Varme artikler
Varme artikler
-
 Katalysatorfremskridt forbedrer naturgasrensningsteknologiKatalysator flåder af palladium (Pd) oxid, der holdes sammen med enkelte atomer af platin, er effektive til at rense emissioner fra naturgasmotorer. Kredit:Cortland Johnson, PNNL. En nyudviklet ka
Katalysatorfremskridt forbedrer naturgasrensningsteknologiKatalysator flåder af palladium (Pd) oxid, der holdes sammen med enkelte atomer af platin, er effektive til at rense emissioner fra naturgasmotorer. Kredit:Cortland Johnson, PNNL. En nyudviklet ka -
 Ny terapeutisk strategi mod sovesygeStruktur af grænsefladen mellem PEX14 og PEX5 (bagpå) inklusive strukturen af inhibitoren (foran). Kredit:Dr. Grzegorz Popowicz, Helmholtz Zentrum München Et nyudviklet lille molekyle dræber sel
Ny terapeutisk strategi mod sovesygeStruktur af grænsefladen mellem PEX14 og PEX5 (bagpå) inklusive strukturen af inhibitoren (foran). Kredit:Dr. Grzegorz Popowicz, Helmholtz Zentrum München Et nyudviklet lille molekyle dræber sel -
 Forbedret forståelse af industrielle elektrodeprocesserElektroden, der bruges til målingerne, er kun en hundrededel i tykkelsen af et menneskehår. Kredit:RUB, Marquard I den industrielle produktion af klor, specielle elektroder er for nylig blevet i
Forbedret forståelse af industrielle elektrodeprocesserElektroden, der bruges til målingerne, er kun en hundrededel i tykkelsen af et menneskehår. Kredit:RUB, Marquard I den industrielle produktion af klor, specielle elektroder er for nylig blevet i -
 Humlet øl uden eksploderende flasker og for meget alkoholKredit:American Chemical Society Den glemte kunst at tør-hoppe øl for at forbedre smagen er tilbage på mode. Men denne praksis har undertiden uønskede bivirkninger, såsom et uventet højt alkoholin
Humlet øl uden eksploderende flasker og for meget alkoholKredit:American Chemical Society Den glemte kunst at tør-hoppe øl for at forbedre smagen er tilbage på mode. Men denne praksis har undertiden uønskede bivirkninger, såsom et uventet højt alkoholin
- Sådan gennemføres kemiske reaktioner
- Sådan konverteres fra Centistoke til Centipoise
- Hurtig levering rammer Amazons bundlinje; aktien falder
- EU's medlemslande skal stemme om en femårig fornyelse af ukrudtsmiddel i næste måned
- Innovation baner vejen for sensorgrænseflader, der er 30 gange mindre
- Lære børn om klimaændringer? Denne tilstand kan kræve det


