Hvordan bryder opløsningsmiddelpartiklerne op fra opløst stof?
1. Forståelse af kræfterne
* opløsningsopløselige kræfter: Dette er de attraktive kræfter, der holder de opløste molekyler sammen. De kan være stærke (som ioniske bindinger i salte) eller svage (som van der Waals -kræfter i ikke -polære molekyler).
* opløsningsmiddel-opløsningsmiddelkræfter: Dette er de attraktive kræfter, der holder opløsningsmiddelmolekylerne sammen. I lighed med løsning af opløst opløsning kan de variere i styrke.
* opløsning af opløsningsmidler: Dette er de attraktive kræfter mellem de opløste og opløsningsmiddelmolekyler.
2. Opløsningsprocessen
* Breaking Bonds: Opløsningsmiddelmolekylerne skal overvinde de opløste opløsningsstyrker for at adskille de opløste molekyler. Dette er en endotermisk proces, hvilket betyder, at det kræver energi.
* danner nye obligationer: Når opløsningsmiddelmolekylerne omgiver de opløste molekyler, danner de nye opløste opløsningsmiddelbindinger. Dette er en eksoterm proces, frigivelse af energi.
* gunstige forhold: Opløsning opstår, når energien, der frigives fra dannelse af nye opløste opløsningsmiddelbindinger, er større end den energi, der kræves for at bryde de opløste opløsningsobligationer.
3. Typer af solvation
* Hydrering: Når vand er opløsningsmidlet, kaldes processen hydrering. Vandmolekyler har et stærkt dipolmoment, hvilket giver dem mulighed for at danne brintbindinger med mange typer opløste stoffer.
* solvation: Dette er et mere generelt udtryk, der bruges til processen med en opløst stof, der opløses i ethvert opløsningsmiddel.
Eksempler
* salt (NaCl) i vand: Vandmolekyler med deres delvise ladninger tiltrækker ioner af saltet, bryder de ioniske bindinger og trækker dem fra hinanden.
* sukker (C12H22O11) i vand: Vandmolekyler danner hydrogenbindinger med de polære hydroxylgrupper (-OH) på sukkermolekylerne, hvilket bryder sukkerstrukturen op.
* olie i vand: Olie er ikke -polær og har svage intermolekylære kræfter. Vand er polært med stærk hydrogenbinding. Kræfterne mellem olie- og vandmolekyler er meget svage, så olie opløses ikke i vand.
Nøglepunkter:
* Styrken af de intermolekylære kræfter mellem opløst stof og opløsningsmiddelmolekyler bestemmer opløseligheden.
* "Som opløser som" er en generel regel. Polære opløsningsmidler har en tendens til at opløse polære opløste stoffer, og ikke -polære opløsningsmidler har en tendens til at opløse ikke -polære opløste stoffer.
* Temperatur og tryk kan også påvirke opløseligheden af et stof.
Fortæl mig, hvis du har flere spørgsmål!
Sidste artikelHvad er det videnskabelige navn for Na2B4O7?
Næste artikelHvilken atompartikel er lig med dens antal?
 Varme artikler
Varme artikler
-
 Sukkerovertrukket verdenGlycaner eller polysaccharider pryder celleoverflader og er vigtige for cellekommunikation, immunrespons og mange andre vitale fysiologiske processer. En ny undersøgelse samler et bibliotek af enzymer
Sukkerovertrukket verdenGlycaner eller polysaccharider pryder celleoverflader og er vigtige for cellekommunikation, immunrespons og mange andre vitale fysiologiske processer. En ny undersøgelse samler et bibliotek af enzymer -
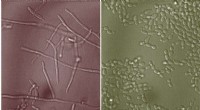 Molekyler fundet i slim kan modvirke svampeinfektionDen mere smitsomme form for gæren Candida albicans er en lang filament (til venstre). MIT-forskere har vist, at når gæren dyrkes i nærværelse af mucinglykaner, forbliver den i sin runde, harmløse form
Molekyler fundet i slim kan modvirke svampeinfektionDen mere smitsomme form for gæren Candida albicans er en lang filament (til venstre). MIT-forskere har vist, at når gæren dyrkes i nærværelse af mucinglykaner, forbliver den i sin runde, harmløse form -
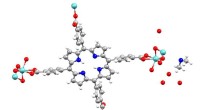 MOF datasæt giver 10, 000 strukturer gratis til akademisk forskningCambridge Crystallographic Data Center (CCDC) har lavet omkring 10, 000 metal-organiske rammestrukturer gratis for akademikere i den nye CSD MOF-samling. Kredit:CCDC - Cambridge Crystallographic Data
MOF datasæt giver 10, 000 strukturer gratis til akademisk forskningCambridge Crystallographic Data Center (CCDC) har lavet omkring 10, 000 metal-organiske rammestrukturer gratis for akademikere i den nye CSD MOF-samling. Kredit:CCDC - Cambridge Crystallographic Data -
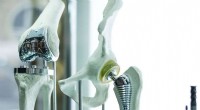 Løsning af problemet med kirurgisk rustfrit stålKredit:University of Montreal Rustfrit stål bruges meget i kirurgisk medicin:til medicinsk udstyr, såsom koronarstenter, hofteimplantatstængler og udskiftning af rygmarvsskive, og til en række for
Løsning af problemet med kirurgisk rustfrit stålKredit:University of Montreal Rustfrit stål bruges meget i kirurgisk medicin:til medicinsk udstyr, såsom koronarstenter, hofteimplantatstængler og udskiftning af rygmarvsskive, og til en række for
- Hvorfor en person med recessiv fænotype skal vende mønt bestemme deres genotype?
- Fysikere læser Maxwells Demons sind
- Hvilket kemikalie er et enzym?
- Kan opdagelsen af nøglegensystemet være at kvæle korallers sidste gisp?
- Forskergruppen finder, at grafen kan bane vejen for nye former for optoelektroniske enheder
- Døende laks plager Norges store dambrugsindustri


