Molekylær arrangement af fast flydende gas?
faste stoffer
* Meget bestilt: Molekyler er tæt pakket og arrangeret i et regelmæssigt, gentagende mønster kaldet en krystalgitter.
* Stærke intermolekylære kræfter: Molekylerne holdes sammen af stærke intermolekylære kræfter (som ioniske bindinger, kovalente bindinger eller metalliske bindinger). Dette holder dem i en fast position.
* Fast form og volumen: Faststoffer opretholder deres form og volumen. De er ukomprimerbare på grund af den tætte pakning af molekyler.
væsker
* mindre bestilt: Molekyler er tættere sammen end i gasser, men har mere bevægelsesfrihed end i faste stoffer. De kan glide forbi hinanden.
* Moderat intermolekylære kræfter: Intermolekylære kræfter er svagere end i faste stoffer, men stadig betydningsfulde nok til at holde molekyler relativt tæt sammen.
* fast volumen, variabel form: Væsker opretholder et konstant volumen, men tag formen på deres beholder. De er lidt komprimerbare.
Gasser
* Ingen fast arrangement: Molekyler er langt fra hinanden og bevæger sig frit i tilfældige retninger med høj kinetisk energi.
* svage intermolekylære kræfter: Intermolekylære kræfter er meget svage, hvilket muliggør betydelig adskillelse mellem molekyler.
* Variabel form og volumen: Gasser fylder hele beholderen, de er i. De er meget komprimerbare på grund af de store rum mellem molekyler.
visuel analogi
Forestil dig en gruppe mennesker:
* fast: Mennesker, der står i en stram, ordnet linje, ikke i stand til at bevæge sig meget.
* væske: Mennesker i et overfyldt rum, der er i stand til at bevæge sig rundt og støde på hinanden, men stadig relativt tæt.
* gas: Folk spredte sig over et stort felt og bevæger sig frit og interagerer sjældent.
Key Takeaways
* Arrangementet af molekyler bestemmer stoftilstanden.
* Styrken af intermolekylære kræfter spiller en nøglerolle i bestemmelsen af, hvor tæt pakket molekyler er, og hvor meget de kan bevæge sig rundt.
* Temperatur påvirker bevægelsen af molekyler, hvilket kan forårsage overgange mellem tilstande (som smeltning eller kogning).
 Varme artikler
Varme artikler
-
 Jane Austen -citat kodet i en polymerEt citat fra Jane Austens Mansfield Park skrevet i oligourethanes. Kredit:Sarah Moor Ved hjælp af en ny molekylær datalagringsteknik, forskere ved University of Texas i Austin har kodet et citat f
Jane Austen -citat kodet i en polymerEt citat fra Jane Austens Mansfield Park skrevet i oligourethanes. Kredit:Sarah Moor Ved hjælp af en ny molekylær datalagringsteknik, forskere ved University of Texas i Austin har kodet et citat f -
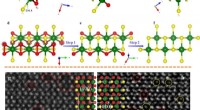 Kontrollerbar overfladedefektteknik på overgangsmetaltrichalcogenidFigur (a-f) viser den skematiske proces for omdannelsen af monoklint zirconiumtrisulfid, ZrS3 (ICCD PDF nr. 30-1498) til sekskantet zirconiumsulfid, ZrS2 (ICCD PDF-nr. 11-0679) fra [010] (a-c) og [0
Kontrollerbar overfladedefektteknik på overgangsmetaltrichalcogenidFigur (a-f) viser den skematiske proces for omdannelsen af monoklint zirconiumtrisulfid, ZrS3 (ICCD PDF nr. 30-1498) til sekskantet zirconiumsulfid, ZrS2 (ICCD PDF-nr. 11-0679) fra [010] (a-c) og [0 -
 Lab-on-a-chip driver søgning efter nye lægemidler for at forhindre blodpropperDen biokompatible enhed indeholder de komplekse funktioner i et patologilaboratorium, i miniature. Kredit:RMIT University Et lille laboratorium på størrelse med et frimærke kan være den næste stor
Lab-on-a-chip driver søgning efter nye lægemidler for at forhindre blodpropperDen biokompatible enhed indeholder de komplekse funktioner i et patologilaboratorium, i miniature. Kredit:RMIT University Et lille laboratorium på størrelse med et frimærke kan være den næste stor -
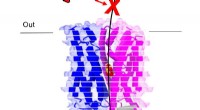 Forskere opdager, hvordan malariaparasitter importerer sukkerStruktur af transportproteinet PfHT1 i kompleks med sukker D-glucose. Kredit:David Drew Forbruget af sukker er en grundlæggende kilde til brændstof i de fleste levende organismer. I malariaparasit
Forskere opdager, hvordan malariaparasitter importerer sukkerStruktur af transportproteinet PfHT1 i kompleks med sukker D-glucose. Kredit:David Drew Forbruget af sukker er en grundlæggende kilde til brændstof i de fleste levende organismer. I malariaparasit
- 5 Forskellige mellem mitose og meiose Samme giver mig en liste plz?
- USA udvider sonde til airbag -fejl til 12,3 millioner biler
- Låser op for mysteriet med katalysatorer
- Verdens første siliciumlaser
- Hvordan kan du bruge kemisk binding og valenselektron i en sætning?
- Hvorfor giver store storme så meget mere regn? Opvarmning, ja, men også vind


