Hvilket atom har en større tiltrækning for elctrons-natrium eller klor?
* Elektronegativitet: Elektronegativitet er et mål for et atoms evne til at tiltrække elektroner i en kemisk binding. Chlor har en højere elektronegativitet (3,16) end natrium (0,93). Dette betyder, at klor har et stærkere træk på delte elektroner.
* Elektronkonfiguration: Chlor (CL) har 7 valenselektroner i sin ydre skal, hvilket gør det til en elektron kort efter en fuld oktet. Dette gør det meget reaktivt og ivrig efter at få et elektron for at opnå stabilitet. Natrium (NA) har kun 1 valenselektron, hvilket gør det lettere at miste denne elektron og opnå en stabil konfiguration.
* ionisk binding: Når natrium- og klorreaktioner, mister natrium let sin valenselektron og bliver en positivt ladet ion (Na+). Klor vinder denne elektron og bliver en negativt ladet ion (Cl-). Denne stærke attraktion mellem modsat ladede ioner danner den ioniske binding i natriumchlorid (NaCl).
I det væsentlige gør klorens højere elektronegativitet og dens tendens til at få et elektron det meget mere attraktivt for elektroner end natrium.
Sidste artikelHvilken teputure bliver en solid væsk?
Næste artikelHvad er opløseligheden af lithiumchlorid?
 Varme artikler
Varme artikler
-
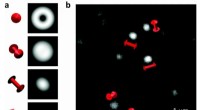 Ny billeddannelsesteknik afslører, hvordan mekanisk skade begynder på molekylær skalaFor at studere materialefejl på molekylært niveau, forskere sammenlignede beregnede billeder af enkelte molekyler i forskellige retninger (til venstre) med eksperimentelle (til højre) for at bestemme
Ny billeddannelsesteknik afslører, hvordan mekanisk skade begynder på molekylær skalaFor at studere materialefejl på molekylært niveau, forskere sammenlignede beregnede billeder af enkelte molekyler i forskellige retninger (til venstre) med eksperimentelle (til højre) for at bestemme -
 Blandingsregler for 3-D printknogleKredit:Pixabay/CC0 Public Domain Ved at kombinere syntetiske polymerer og naturlige materialer er det muligt at øge rækken af egenskaber, der kan fremstilles ved hjælp af 3-D-print af komponente
Blandingsregler for 3-D printknogleKredit:Pixabay/CC0 Public Domain Ved at kombinere syntetiske polymerer og naturlige materialer er det muligt at øge rækken af egenskaber, der kan fremstilles ved hjælp af 3-D-print af komponente -
 Forskere udvikler billige, drop-on-demand printteknikDrop impact printopsætning med genbrugsenhed. Kredit:Nature Communications, Laboratorium for mikrofluidiske enheder og heterogene systemer, CeNSE Forskere ved Center for Nano Science and Engineeri
Forskere udvikler billige, drop-on-demand printteknikDrop impact printopsætning med genbrugsenhed. Kredit:Nature Communications, Laboratorium for mikrofluidiske enheder og heterogene systemer, CeNSE Forskere ved Center for Nano Science and Engineeri -
 Gennemsigtig keramisk rustning giver overlegen ballistisk beskyttelse over traditionelle glaslaminat…Army UH-60M helikopterplatforme bruger gennemsigtige rustningssystemer monteret bag piloterne. Kredit:Air Force Office of Scientific Research Gennemsigtig aluminium, en teknologi, der først blev f
Gennemsigtig keramisk rustning giver overlegen ballistisk beskyttelse over traditionelle glaslaminat…Army UH-60M helikopterplatforme bruger gennemsigtige rustningssystemer monteret bag piloterne. Kredit:Air Force Office of Scientific Research Gennemsigtig aluminium, en teknologi, der først blev f
- Er aftenprimroseolie et naturligt forekommende stof?
- Hvilken trussel udgør vandcyklussen for misbrug?
- Er Red Giant Stars den største?
- Forretningsgrupper, der kun er for kvinder, marginaliserer og formår ikke at styrke medlemmerne
- Hvor går solen hen efter sin solnedgang?
- Forskere udvikler kunstige kemiske receptorer til at hjælpe viral transduktion til T-celleteknik


