Hvad bestemmer formen af et stof?
1. Intermolekylære kræfter:
* attraktive kræfter: Disse kræfter holder molekyler sammen og påvirker stoffets stof. Stærkere attraktive kræfter (som brintbindinger) fører til faste stoffer, mens svagere kræfter (som van der Waals kræfter) resulterer i væsker eller gasser.
* frastødende kræfter: Disse kræfter forhindrer molekyler i at kollapse på hinanden. De bestemmer stoffets densitet og kompressibilitet.
2. Temperatur:
* kinetisk energi: Når temperaturen stiger, bevæger molekyler sig hurtigere og har mere kinetisk energi. Dette svækker intermolekylære kræfter og kan forårsage en overgang fra fast til væske eller væske til gas.
3. Tryk:
* eksternt tryk: Forøgede trykstyrker molekyler tættere sammen, hvilket styrker intermolekylære kræfter. Dette kan føre til en overgang fra gas til væske eller væske til fast stof.
4. Molekylær struktur og binding:
* form og størrelse: Formen og størrelsen af molekyler påvirker, hvordan de pakkes sammen, hvilket påvirker intermolekylære kræfter og stoffets form.
* obligationstype: Typen af bindinger inden for et molekyle (kovalent, ioniske, metalliske) bestemmer også dens egenskaber og i sidste ende dens form.
5. Andre faktorer:
* eksterne felter: Elektriske og magnetiske felter kan påvirke opførslen af molekyler, der påvirker stoffets form.
* urenheder: Tilstedeværelsen af urenheder kan forstyrre det regelmæssige arrangement af molekyler og ændre stoffets egenskaber.
Eksempler:
* Vand: Væske ved stuetemperatur på grund af stærke brintbindinger. Bliver solid (is) ved lave temperaturer og gas (damp) ved høje temperaturer.
* jern: Fast ved stuetemperatur på grund af stærke metalliske bindinger. Det smelter ved høje temperaturer og kan formes, når de opvarmes.
* helium: Gas ved stuetemperatur på grund af svage van der Waals -styrker. Det bliver kun flydende ved ekstremt lave temperaturer og tryk.
Sammenfattende er formen af et stof et resultat af et komplekst samspil mellem intermolekylære kræfter, temperatur, tryk, molekylstruktur og andre faktorer.
 Varme artikler
Varme artikler
-
 Kemikere udvikler urinprøve med papirstrimmel til evaluering derhjemme/på kontoret/klinikkenRobbyn Anand og studerende i hendes forskningsgruppe udvikler en ny papirstrimletest for at opdage coronavirus, der forårsager COVID-19. Kredit:College of Liberal Arts and Sciences Kemikere ved Io
Kemikere udvikler urinprøve med papirstrimmel til evaluering derhjemme/på kontoret/klinikkenRobbyn Anand og studerende i hendes forskningsgruppe udvikler en ny papirstrimletest for at opdage coronavirus, der forårsager COVID-19. Kredit:College of Liberal Arts and Sciences Kemikere ved Io -
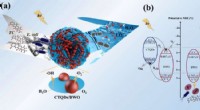 Forskere udvikler Z-skema katalysator for forurenende stoffer i vandSkematisk illustration af fotokatalytisk mekanisme. Kredit:YANG Pengqi I de seneste år, den hurtige industrialisering har forårsaget stadig mere alvorlig miljøforurening. Antibiotika og mikrobiolo
Forskere udvikler Z-skema katalysator for forurenende stoffer i vandSkematisk illustration af fotokatalytisk mekanisme. Kredit:YANG Pengqi I de seneste år, den hurtige industrialisering har forårsaget stadig mere alvorlig miljøforurening. Antibiotika og mikrobiolo -
 Producerer brint ved at bruge mindre energiDr. Laith Almazahreh undersøger mekanismen for elektrokatalytisk brintdannelse med en naturinspireret modelforbindelse ved Friedrich Schiller University Jena. Den elektrokemiske celle indeholder en op
Producerer brint ved at bruge mindre energiDr. Laith Almazahreh undersøger mekanismen for elektrokatalytisk brintdannelse med en naturinspireret modelforbindelse ved Friedrich Schiller University Jena. Den elektrokemiske celle indeholder en op -
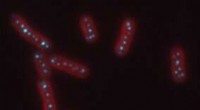 Forståelse af membranen i membranløse organellerPå billedet ses et fluorescensbillede af cyanobakterier, i rødt, med carboxysomer, i cyan. Kredit:Biteen og Vecchiarelli Labs Organeller i celler er små motorer, der indkapsler processer, der till
Forståelse af membranen i membranløse organellerPå billedet ses et fluorescensbillede af cyanobakterier, i rødt, med carboxysomer, i cyan. Kredit:Biteen og Vecchiarelli Labs Organeller i celler er små motorer, der indkapsler processer, der till
- Hvorfor er månen synlig så sent om aftenen?
- To uger i en solplets liv
- Biologer opdager, hvordan alger absorberer fosfor efter tvungen sult
- Hvad ville der være sket med jorden, hvis solen var markant større end den er?
- Global analyse identificerer udsatte skove
- Google Maps giver dig mulighed for at planlægge blandede rejseformer for komplicerede, ture med fle…


