Hvad gør salt i elektrolysen af vand?
1. Forbedring af ledningsevnen:
* Rent vand er en dårlig leder af elektricitet. Dette skyldes, at vandet i sig selv ikke let adskiller sig i ioner.
* Når salt tilsættes, opløses det i dets bestanddele:natriumioner (Na+) og chloridioner (Cl-).
* Disse ioner øger vandets elektriske ledningsevne, hvilket gør det muligt for den elektriske strøm at flyde lettere.
2. Letter reaktionerne:
* ved anoden (positiv elektrode): Chloridioner (Cl-) tiltrækkes af anoden. De mister elektroner og bliver klorgas (CL2).
* ved katoden (negativ elektrode): Vandmolekyler (H2O) tiltrækkes af katoden. De får elektroner og reduceres til brintgas (H2) og hydroxidioner (OH-).
uden salt:
* Elektrolysen af rent vand ville være meget langsomt, hvis det overhovedet skete.
* Reaktionen ville primært producere iltgas ved anoden.
* Meget lidt brintgas ville blive produceret, da vandmolekylerne ville være tilbageholdende med at acceptere elektroner uden tilstedeværelsen af en katalysator.
med salt:
* Tilstedeværelsen af ioner fremskynder signifikant reaktionerne.
* Reaktionerne er mere afbalancerede og producerer både brint og iltgas.
* Tilsætningen af salt forhindrer også opbygning af hydrogenioner (H+) ved katoden, hvilket ellers kan hindre reaktionen.
Vigtig note:
* Saltet, der bruges i elektrolyse af vand, skal være ikke-reaktiv med elektroderne og produkterne. Natriumchlorid (NaCl) er et almindeligt valg, fordi det opfylder dette krav.
* Det er dog vigtigt at bruge rent salt (uden urenheder som calcium eller magnesium) for at undgå forurening af vandet.
Sammenfattende fungerer salt som en elektrolyt i elektrolysen af vand, hvilket muliggør effektiv strøm af strøm og accelererer reaktionerne til at producere brint og iltgas.
 Varme artikler
Varme artikler
-
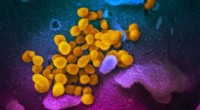 Fordelene ved rekonvalescent plasma til COVID-19 er stadig uklareDette scanningselektronmikroskopbillede viser SARS-CoV-2 (gul)-også kendt som 2019-nCoV, virussen, der forårsager COVID-19-isoleret fra en patient, der kommer fra overfladen af celler (blå/pink) dyr
Fordelene ved rekonvalescent plasma til COVID-19 er stadig uklareDette scanningselektronmikroskopbillede viser SARS-CoV-2 (gul)-også kendt som 2019-nCoV, virussen, der forårsager COVID-19-isoleret fra en patient, der kommer fra overfladen af celler (blå/pink) dyr -
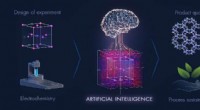 Maskinlæring kunne lære os, hvordan man gør fremstilling af materialer renere og mere bæredygtigMaskinlæring og design af eksperimenter kan kombineres for at identificere den mest bæredygtige metode til udvikling af avancerede materialer. Kredit:020 KAUST; Xavier Pita Kemi computeralgoritme
Maskinlæring kunne lære os, hvordan man gør fremstilling af materialer renere og mere bæredygtigMaskinlæring og design af eksperimenter kan kombineres for at identificere den mest bæredygtige metode til udvikling af avancerede materialer. Kredit:020 KAUST; Xavier Pita Kemi computeralgoritme -
 Høst rent brintbrændstof gennem kunstig fotosynteseDet farvede elektronmikroskopbillede viser galliumnitridtårnene i den kunstige fotosynteseanordning ved 52,5k forstørrelse. Disse nanostrukturer river vandmolekyler fra hinanden til brint og ilt for a
Høst rent brintbrændstof gennem kunstig fotosynteseDet farvede elektronmikroskopbillede viser galliumnitridtårnene i den kunstige fotosynteseanordning ved 52,5k forstørrelse. Disse nanostrukturer river vandmolekyler fra hinanden til brint og ilt for a -
 Polymerer bliver fanget af kærlighed-hadkemi af olie og vandForskere ved Oak Ridge National Laboratory og University of Tennessee sporede polymerselvsamling ved væske-væske-grænsefladen i realtid. Kredit:Michelle Lehman/Oak Ridge National Laboratory, US Depart
Polymerer bliver fanget af kærlighed-hadkemi af olie og vandForskere ved Oak Ridge National Laboratory og University of Tennessee sporede polymerselvsamling ved væske-væske-grænsefladen i realtid. Kredit:Michelle Lehman/Oak Ridge National Laboratory, US Depart
- Hvilket dyr har skarpe tænder og har udviklet spisekød?
- Māori-forbindelser til Antarktis kan gå så langt tilbage som det 7. århundrede
- Brug af radikaliserede NOₓ-derivater understøttet på metaloxider
- Fordele og ulemper ved typer broer
- Entomolog forklarer, hvorfor du ikke bør dræbe edderkopper i dit hjem
- Er det Great Lake-ulve eller wannabes?


