Hvad er forskellen mellem ophidset hydrogenatom og noget andet atom?
ophidset hydrogenatom:
* elektron i et højere energiniveau: I et normalt hydrogenatom optager den enkelte elektron jordtilstanden (n =1). Når det absorberer energi (f.eks. Fra lys), springer den til et højere energiniveau (n =2, 3 osv.). Dette er den ophidsede tilstand.
* ustabil: Den ophidsede tilstand er ustabil. Elektronet vil til sidst frigive den absorberede energi og vende tilbage til jordtilstanden og ofte udsende lys i processen.
* Unikt emissionsspektrum: De specifikke bølgelængder af lys, der udsendes under de-excitation, er unikke for brint og danner dets karakteristiske linjespektrum.
Ethvert andet atom:
* Flere elektroner: Andre atomer har flere elektroner, der hver besætter forskellige energiniveauer.
* mere komplekse energiniveau: Energiniveauet i multi-elektronatomer er mere komplekse på grund af interaktioner mellem elektroner.
* mere komplekse emissionsspektre: Emissionsspektre for andre atomer er mere komplekse end brint med mange flere mulige overgange og linjer.
Kortfattet:
Den grundlæggende forskel er, at et ophidset hydrogenatom er et hydrogenatom med dets elektron i et højere energiniveau end dens jordtilstand. Denne excitation er en midlertidig tilstand, og elektronet vil til sidst vende tilbage til sin jordtilstand. Andre atomer har også begejstrede tilstande, men deres energiniveau og emissionsspektre er mere komplekse på grund af tilstedeværelsen af flere elektroner og interaktioner mellem dem.
 Varme artikler
Varme artikler
-
 Kemikere ændrer fuldstændig retningen af Diels-Alder-reaktionenOmdannelse af addukter af tangtype til addukter af dominotype med temperaturstigning. Kredit:Fedor Zubkov (illustrationen af Eugenia Lavrova). RUDN-baserede forskere, sammen med russiske kollege
Kemikere ændrer fuldstændig retningen af Diels-Alder-reaktionenOmdannelse af addukter af tangtype til addukter af dominotype med temperaturstigning. Kredit:Fedor Zubkov (illustrationen af Eugenia Lavrova). RUDN-baserede forskere, sammen med russiske kollege -
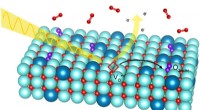 En ny facet af brændselscellekemiRøntgenstråler tillod forskere at se iltgasmolekyler klæbe til en specielt forberedt elektrodeoverflade, et vigtigt skridt i den elektrokemiske reaktion, der finder sted i brændselsceller. Kredit:Abel
En ny facet af brændselscellekemiRøntgenstråler tillod forskere at se iltgasmolekyler klæbe til en specielt forberedt elektrodeoverflade, et vigtigt skridt i den elektrokemiske reaktion, der finder sted i brændselsceller. Kredit:Abel -
 Nanomaterialer - korte polymerer, stor indflydelseForskere brugte computersimuleringer til at producere billeder af polymer nanokompositmaterialer. Nanopartikler er vist i pink og lange polymerkæder i cyan. Kredit:Jan-Michael Y. Carrillo/ORNL, US Dep
Nanomaterialer - korte polymerer, stor indflydelseForskere brugte computersimuleringer til at producere billeder af polymer nanokompositmaterialer. Nanopartikler er vist i pink og lange polymerkæder i cyan. Kredit:Jan-Michael Y. Carrillo/ORNL, US Dep -
 Vil fremtidens superbatterier være lavet af havvand?Kredit:CC0 Public Domain Vi kender alle de genopladelige og effektive lithium-ion (Li-ion) batterier, der sidder i vores smartphones, bærbare computere og også i elbiler. Desværre, lithium er en
Vil fremtidens superbatterier være lavet af havvand?Kredit:CC0 Public Domain Vi kender alle de genopladelige og effektive lithium-ion (Li-ion) batterier, der sidder i vores smartphones, bærbare computere og også i elbiler. Desværre, lithium er en
- Ring af ildformørkelse glæder Afrika, Sydamerika
- Vand kan være nøglen til at forstå sødme
- Hvad får hjernen til at tikke, tikke...
- Australopithecus sediba hominin:Ny undersøgelse afslører, hvordan menneskets forfader gik, tyggede…
- Hvornår blev vejr satellitter opfundet?
- En astronaut kaster en bold på månen, du kaster en identisk jord ved hjælp af samme kraft, der vi…


