Da elektroner blev opdaget, udledte videnskabsmand, at neutrale atomer indeholder positive ladninger, fordi?
* J.J. Thomsons Cathode Ray Experiment: Thomsons eksperimenter viste, at katodestråler (som vi nu ved er bjælker af elektroner) var negativt ladede partikler.
* atomer er normalt neutrale: Atomer er elektrisk neutrale. Dette betyder, at de ikke har nogen nettoafgift. Hvis atomer indeholder negativt ladede elektroner, skal der være en afbalancerende positiv ladning for at opretholde neutralitet.
* "Plum budding" -modellen: Thomson foreslog atomets "blommepudding", der forestillede sig en positivt ladet sfære med negativt ladede elektroner indlejret i den. Denne model, skønt senere modbevist, hjalp med at forklare atomernes neutralitet.
senere opdagelser:
* Rutherfords guldfolieeksperiment: Ernest Rutherfords berømte eksperiment, hvor alfa -partikler blev fyret ved en tynd guldfolie, viste, at de fleste partikler passerede igennem, men nogle blev afbøjet i store vinkler. Dette førte til opdagelsen af kernen, en tæt, positivt ladet region i midten af atomet.
Kortfattet: Opdagelsen af negativt ladede elektroner kombineret med forståelsen af, at atomer er neutrale, førte forskere til at udlede eksistensen af positive ladninger inden for atomer. Rutherfords arbejde bekræftede senere dette med opdagelsen af den positivt ladede kerne.
 Varme artikler
Varme artikler
-
 Ny legering til at løse blyproblem i drikkevandUNSW-forskere har skabt en blyfri messinglegering til brug i VVS, der gør drikkevand sikrere. Kredit:Shutterstock Materialeforskere ved UNSW Sydney har fundet frem til en blyfri messinglegering ti
Ny legering til at løse blyproblem i drikkevandUNSW-forskere har skabt en blyfri messinglegering til brug i VVS, der gør drikkevand sikrere. Kredit:Shutterstock Materialeforskere ved UNSW Sydney har fundet frem til en blyfri messinglegering ti -
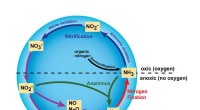 Undersøgelse af forviklingerne i nitrogenkredsløbetDenne grafik fremhæver nogle af de vigtigste reaktioner i nitrogenkredsløbet, skudt i gang med brugen af ammoniak eller NH3 , gødning. MSUs nye forskning zoomer ind på reaktioner, der involverer nit
Undersøgelse af forviklingerne i nitrogenkredsløbetDenne grafik fremhæver nogle af de vigtigste reaktioner i nitrogenkredsløbet, skudt i gang med brugen af ammoniak eller NH3 , gødning. MSUs nye forskning zoomer ind på reaktioner, der involverer nit -
 Effekter af tværbinderlængde på anionbyttermembranbrændselscellerFremskridt inden for brændselscelleteknologi vil hjælpe os kraftigt med at reducere vores brug af fossile brændstoffer til at generere elektricitet, fører til mindre luftforurening. Kredit:Chris LeBou
Effekter af tværbinderlængde på anionbyttermembranbrændselscellerFremskridt inden for brændselscelleteknologi vil hjælpe os kraftigt med at reducere vores brug af fossile brændstoffer til at generere elektricitet, fører til mindre luftforurening. Kredit:Chris LeBou -
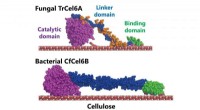 Bakteriel cellulosenedbrydningssystem kunne sætte skub i produktionen af biobrændstofferStrukturelle modeller af svampe- og bakteriecellobiohydrolaser (TrCel6A, CfCel6B) Kredit:NINS/IMS Bestræbelser på at finde måder at nedbryde cellulose - de hårde ting, der udgør plantecellevægge -
Bakteriel cellulosenedbrydningssystem kunne sætte skub i produktionen af biobrændstofferStrukturelle modeller af svampe- og bakteriecellobiohydrolaser (TrCel6A, CfCel6B) Kredit:NINS/IMS Bestræbelser på at finde måder at nedbryde cellulose - de hårde ting, der udgør plantecellevægge -


