Hvordan er en ionisk binding mellem to malm flere atomer?
Spillerne:
* Metaller: Disse elementer har en tendens til at miste elektroner og blive positivt ladede ioner kaldet *kationer *. De har en lav elektronegativitet (tiltrækning for elektroner).
* ikke -metaller: Disse elementer har en tendens til at vinde elektroner og bliver negativt ladede ioner kaldet *anioner *. De har en høj elektronegativitet.
Processen:
1. Elektroneroverførsel: Når et metalatom støder på et ikke -metalatom, donerer metalatomet let en eller flere af dets valenselektroner (yderste elektroner) til ikke -metalatomet.
2. modsatte afgifter tiltrækker: Metalatomet, der har mistet elektroner, bliver en positivt ladet kation. Det ikke -metale atom, der har fået elektroner, bliver en negativt ladet anion. Disse modsatte afgifter skaber en stærk elektrostatisk tiltrækning mellem ionerne.
3. Dannelse af den ioniske binding: Denne elektrostatiske attraktion holder ionerne sammen og danner en stabil ionisk binding.
Nøglepunkter:
* Elektronegativitetsforskel: Drivkraften bag ionisk bindingsdannelse er en signifikant forskel i elektronegativitet mellem metallet og ikke -metal. Jo større forskellen er, desto mere sandsynligt vil der dannes en ionisk binding.
* krystalgitterstruktur: Ioniske forbindelser har en tendens til at danne krystallinske strukturer, hvor ionerne er arrangeret i et stærkt ordnet, gentagende mønster. Denne struktur maksimerer tiltrækningen mellem modsat ladede ioner.
* Stærke obligationer: Ioniske bindinger er generelt stærkere end kovalente bindinger på grund af de stærke elektrostatiske kræfter, der holder ionerne sammen.
Eksempel:natriumchlorid (NaCl)
* natrium (NA): Et metal, der let mister et elektron for at blive en +1 -kation (Na +).
* klor (Cl): En ikke -metal, der let får en elektron til at blive en -1 -anion (Cl-).
Natriumatomet donerer sit elektron til chloratomet og danner en stabil ionisk binding mellem de modsatte ladede ioner:Na+Cl-
Vigtig note: Ioniske bindinger er ikke blot en deling af elektroner som kovalente bindinger. De involverer en komplet overførsel af elektroner, hvilket resulterer i dannelse af positivt og negativt ladede ioner.
 Varme artikler
Varme artikler
-
 Kollektiv adskillelse af sammenfiltrede polymererEt aktin filament i bevægelse. Kredit:C. Hohmann, NIM LMU-forskere har modbevist den konventionelle teori, der bruges til at forklare dynamikken i polymerløsninger. De viser, at for biopolymerer f
Kollektiv adskillelse af sammenfiltrede polymererEt aktin filament i bevægelse. Kredit:C. Hohmann, NIM LMU-forskere har modbevist den konventionelle teori, der bruges til at forklare dynamikken i polymerløsninger. De viser, at for biopolymerer f -
 Eksponering for ultraviolet lys øger syntetisk melanins beskyttende evneKredit:University of Akron Melanins høje brydningsindeks (RI) og bredbåndsabsorptionsevne bidrager til pigmentets evne til at beskytte mod ultraviolet stråling (UV). Disse optiske egenskaber bidra
Eksponering for ultraviolet lys øger syntetisk melanins beskyttende evneKredit:University of Akron Melanins høje brydningsindeks (RI) og bredbåndsabsorptionsevne bidrager til pigmentets evne til at beskytte mod ultraviolet stråling (UV). Disse optiske egenskaber bidra -
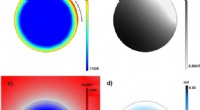 Udvikling af 3-D partikelmodel for enkeltpartikler i batterielektroderElektrokemiske fænomener inde i en enkelt partikel forudsagt ved hjælp af den udviklede model. a) Opladet tilstand; b) Elektrisk potentiale; c) Lithiumkoncentration; d) Spænding. Kredit:DGIST Der
Udvikling af 3-D partikelmodel for enkeltpartikler i batterielektroderElektrokemiske fænomener inde i en enkelt partikel forudsagt ved hjælp af den udviklede model. a) Opladet tilstand; b) Elektrisk potentiale; c) Lithiumkoncentration; d) Spænding. Kredit:DGIST Der -
 Model forudsiger polymer mademballager tilbøjelighed til at absorbere aromamolekyler fra deres indh…Kredit:CC0 Public Domain Dine yndlingsfødevarer og drikkevarer vil snart kunne smage endnu bedre, takket være nye beregninger udviklet på A*STAR. En væsentlig kilde til tab af smag til mad og drik
Model forudsiger polymer mademballager tilbøjelighed til at absorbere aromamolekyler fra deres indh…Kredit:CC0 Public Domain Dine yndlingsfødevarer og drikkevarer vil snart kunne smage endnu bedre, takket være nye beregninger udviklet på A*STAR. En væsentlig kilde til tab af smag til mad og drik
- Hvad er mineralernes rækkefølge fra blødeste til hårdest?
- Boeing færdiggør anti-stall-opdatering efter Etiopiens styrt
- Anmeldelse:Motorola Moto G7 er den billige Android-telefon, du har ventet på
- Et realityshow med dybde:Live havudforskning
- Hvad er en højre gluteal masse?
- Hvem har ansvaret, når klimaforandringerne skader verdens fattigste lande, og hvordan ser kompensat…


