Hvordan kan klassificeringen af oxider relateres til deres metalliske og ikke-metalliske karakter?
1. Metallisk karakter:
* metaller har en tendens til at miste elektroner og danne positive ioner (kationer).
* metaloxider er generelt grundlæggende i naturen. Dette betyder, at de reagerer med syrer for at danne salte og vand.
* Eksempler:
* natriumoxid (Na₂o): Et stærkt reaktivt grundlæggende oxid reagerer kraftigt med vand til dannelse af natriumhydroxid (NaOH).
* calciumoxid (CAO): Brugt i cement og mørtel på grund af dens grundlæggende karakter.
2. Ikke-metallisk karakter:
* ikke-metaler har en tendens til at vinde elektroner og danne negative ioner (anioner).
* Ikke-metaloxider er generelt sure i naturen. Dette betyder, at de reagerer med baser for at danne salte og vand.
* Eksempler:
* kuldioxid (co₂): Opløser i vand til dannelse af kulsyre (H₂CO₃), en svag syre.
* svovldioxid (SO₂): Reagerer med vand til dannelse af svovlsyre (H₂so₃), ansvarlig for surt regn.
3. Amfoterisk karakter:
* Nogle elementer , især dem, der findes i nærheden af den "metalloid" grænse på den periodiske tabel, kan udvise både metallisk og ikke-metallisk karakter.
* amfoteriske oxider kan reagere med både syrer og baser.
* Eksempler:
* aluminiumoxid (al₂o₃): Reagerer med syrer til dannelse af aluminiumssalte og med baser til dannelse af aluminater.
* zinkoxid (ZnO): Brugt i solcreme og pigmenter på grund af dens amfoteriske karakter.
Sammendrag:
* Metalliske oxider: Grundlæggende reagerer med syrer.
* Ikke-metalliske oxider: Syre, reagerer med baser.
* amfoteriske oxider: Reagere med både syrer og baser.
Forståelse af tendensen:
* på tværs af en periode: Metallisk karakter falder generelt, og ikke-metallisk karakter øges. Derfor bliver oxider stadig mere sure.
* ned en gruppe: Metallisk karakter øges generelt, og ikke-metallisk karakter falder. Derfor bliver oxider stadig mere basale.
Klassificeringen af oxider baseret på deres metalliske og ikke-metalliske karakter giver en nyttig ramme for at forstå deres kemiske egenskaber og reaktivitet.
Sidste artikelHvilken type kemisk reaktion producerer mindre forbindelser?
Næste artikelEr salt en elektrolyt eller ikke -elektrolyt?
 Varme artikler
Varme artikler
-
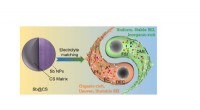 Opnåelse af stabil K-lagringsydelse af carbonkugle-begrænset antimon via elektrolytreguleringDen interne mikrostruktur af Sb@CS med ensartet fordeling af C og Sb udviser helt forskellige egenskaber i to typiske elektrolytter, men den elektrokemiske ydeevne kan opretholde stabilitet efter elek
Opnåelse af stabil K-lagringsydelse af carbonkugle-begrænset antimon via elektrolytreguleringDen interne mikrostruktur af Sb@CS med ensartet fordeling af C og Sb udviser helt forskellige egenskaber i to typiske elektrolytter, men den elektrokemiske ydeevne kan opretholde stabilitet efter elek -
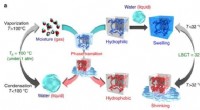 Forskere rapporterer om en temperaturfølsom gel, der absorberer og frigiver fugtIllustration af hovedbegreberne beskrevet i dette papir. Kredit:Kansai University Takashi Miyata ved Kansai University og kolleger melder ind Naturkommunikation en temperaturfølsom gel, der abso
Forskere rapporterer om en temperaturfølsom gel, der absorberer og frigiver fugtIllustration af hovedbegreberne beskrevet i dette papir. Kredit:Kansai University Takashi Miyata ved Kansai University og kolleger melder ind Naturkommunikation en temperaturfølsom gel, der abso -
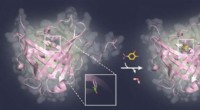 Blokering af sukkerstrukturer på vira og tumorcellerProf. Skerras aktuelle forskningsresultater baner vejen for udviklingen af nye typer bindingsproteiner til biologiske sukkerstrukturer, som spiller en væsentlig rolle ved kræft såvel som infektionss
Blokering af sukkerstrukturer på vira og tumorcellerProf. Skerras aktuelle forskningsresultater baner vejen for udviklingen af nye typer bindingsproteiner til biologiske sukkerstrukturer, som spiller en væsentlig rolle ved kræft såvel som infektionss -
 Video:Blev din katalysator stjålet? Her er hvorforKredit:The American Chemical Society Katalysatorer reducerer giftige bilemissioner, og, ifølge U.S. Environmental Protection Agency, de er en af de største miljøopfindelser nogensinde. I dag, t
Video:Blev din katalysator stjålet? Her er hvorforKredit:The American Chemical Society Katalysatorer reducerer giftige bilemissioner, og, ifølge U.S. Environmental Protection Agency, de er en af de største miljøopfindelser nogensinde. I dag, t
- Hvor mange atomer er der i calciumnitrat?
- SpaceX opsender last til rumstation ved hjælp af genbrugsraket, rumskib
- Hvordan sætter du videnskabelig teori i en sætning?
- Når forskere samler genstande, der er ens på en eller anden måde, er de?
- Karakteristika for Stratosphere
- Hvilken sætning beskriver en videnskabelig lov?


