Hvad sker der med partiklerne, når de opvarmes i en væske?
1. Øget kinetisk energi: Varmeenergi overføres til de flydende partikler, hvilket får dem til at vibrere og bevæge sig hurtigere. Dette er kendt som øget kinetisk energi .
2. Større afstand: Når partiklerne bevæger sig hurtigere, kolliderer de oftere og med større kraft. Dette får dem til at sprede sig, hvilket øger den gennemsnitlige afstand mellem dem. Væsken udvides lidt som et resultat.
3. Svækkelse af intermolekylære kræfter: Den øgede kinetiske energi svækker også de attraktive kræfter (intermolekylære kræfter), der holder partiklerne sammen. Dette betyder, at partiklerne er mindre tæt bundet og kan bevæge sig mere frit.
4. Ændring i tilstand: Hvis væsken opvarmes nok, får partiklerne nok kinetisk energi til at overvinde de intermolekylære kræfter helt. På dette tidspunkt skifter væsken tilstand fra væske til gas (fordampning eller kogning).
her er en simpel analogi: Forestil dig et overfyldt dansegulv med folk, der står tæt sammen. Efterhånden som musikken bliver højere og hurtigere (varmeenergi), begynder folket at danse mere kraftigt (øget kinetisk energi). De støder på hinanden oftere, hvilket får dem til at sprede sig lidt (større afstand) og bevæge sig mere frit (svækkelse af kræfter). Hvis musikken bliver højt nok, begynder folk måske at hoppe så meget, at de forlader dansegulvet helt (statskifte).
Vigtig note: De nøjagtige ændringer og temperaturen, hvorpå de forekommer, afhænger af den specifikke væske og dens egenskaber. For eksempel koger vand ved 100 ° C, mens ethanol koger ved 78,37 ° C.
 Varme artikler
Varme artikler
-
 At knække bitumenpuslespilletBitumenoverflade afbildet med forskellige mikroskopiske teknikker:AFM (topografibillede) og AFM-IR (kemisk fordeling - IR-absorption ved 1262 cm-1). Kredit:TU Wien Mens atomkraftmikroskopi og scan
At knække bitumenpuslespilletBitumenoverflade afbildet med forskellige mikroskopiske teknikker:AFM (topografibillede) og AFM-IR (kemisk fordeling - IR-absorption ved 1262 cm-1). Kredit:TU Wien Mens atomkraftmikroskopi og scan -
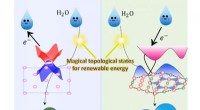 Fremskynde brintproduktionen ved hjælp af de magiske topologiske overfladetilstandeTopologiske ikke-trivielle overfladetilstande kan acceptere eller donere elektroner under vandelektrolyseprocessen. Kredit:MPI CPfS Brintøkonomien anses for at være en af de bedste muligheder fo
Fremskynde brintproduktionen ved hjælp af de magiske topologiske overfladetilstandeTopologiske ikke-trivielle overfladetilstande kan acceptere eller donere elektroner under vandelektrolyseprocessen. Kredit:MPI CPfS Brintøkonomien anses for at være en af de bedste muligheder fo -
 Skaber et ikke-giftigt alternativ til farvet røgKredit:imago images / Shotshop Farvet røg bliver i stigende grad brugt som et skueelement i et bredt spektrum af offentlige arrangementer. Imidlertid, de kemikalier, der anvendes til dette formål,
Skaber et ikke-giftigt alternativ til farvet røgKredit:imago images / Shotshop Farvet røg bliver i stigende grad brugt som et skueelement i et bredt spektrum af offentlige arrangementer. Imidlertid, de kemikalier, der anvendes til dette formål, -
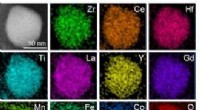 En schweizisk hærkniv-katalysator kan gøre naturgasforbrændingen renereDe grundstoffer, der udgør metaloxid-nanopartikelkatalysatoren. Kredit:Zhennan Huang Reza Shahbazian-Yassar, professor i maskin- og industriteknik ved University of Illinois, Chicago. Shahbazian-
En schweizisk hærkniv-katalysator kan gøre naturgasforbrændingen renereDe grundstoffer, der udgør metaloxid-nanopartikelkatalysatoren. Kredit:Zhennan Huang Reza Shahbazian-Yassar, professor i maskin- og industriteknik ved University of Illinois, Chicago. Shahbazian-
- Ved vi virkelig mere om rummet end det dybe hav?
- Vodafone forsegler fusion til at blive Indias største telekoncern
- Skovundersøgelser viser, hvordan planter tilpasser sig stigende kuldioxid
- I døde organismer Hvilken ændring ville du forvente over tid?
- Prisbillig blysensor til hjemmet, byens vandledninger
- Hvordan kan et rødt skift fortælle os, hvor hurtigt genstanden bevæger sig væk fra jorden?


