Hvilke elementer reagerer med aluminium for at blive de nærmeste ædle gasser?
1. Aluminiums elektronkonfiguration
Aluminium (AL) har et atomnummer på 13, hvilket betyder, at det har 13 elektroner. Dens elektronkonfiguration er:
* 1S² 2S² 2p⁶ 3S² 3p¹
2. Den nærmeste ædle gas
Den nærmeste ædle gas til aluminium er argon (AR) , som har en elektronkonfiguration af:
* 1S² 2S² 2P⁶ 3S² 3P⁶
3. Opnå en ædelgaskonfiguration
Aluminium skal få 3 elektroner for at have den samme elektronkonfiguration som Argon. For at gøre dette vil det typisk danne ioniske bindinger med ikke -metaller, hvilket giver væk sine 3 valenselektroner.
4. Elementer, der reagerer med aluminium
Her er nogle almindelige elementer, der reagerer med aluminium til dannelse af ioniske forbindelser, hvilket gør det muligt for aluminium at opnå en stabil ædelgaskonfiguration:
* halogener (gruppe 17): Fluor (F), klor (CL), brom (BR), iod (I)
* ilt (O): Aluminiumoxid (al₂o₃)
* svovl (r): Aluminiumsulfid (Al₂s₃)
Eksempel:
Når aluminium reagerer med klor, danner det aluminiumchlorid (ALCL₃).
* al (3 valenselektroner) + 3Cl (7 valenselektroner hver) → alcl₃
* Aluminium mister sine 3 valenselektroner og bliver en +3 ion (al³⁺).
* Hvert kloratom får en elektron og bliver -1 -ioner (CL⁻).
* Den resulterende forbindelse har en neutral ladning, og aluminium har opnået en ædelgaskonfiguration som Argon.
Vigtig note: Mens aluminium har en tendens til at danne ioniske forbindelser, kan det også danne kovalente bindinger med elementer som carbon i forbindelser som aluminiumskarbid (Al₄c₃).
 Varme artikler
Varme artikler
-
 Team udvikler kræftbilleddannelseshjælp fra hestekastanjerMolekyler afledt af hestekastanjer hjælper kræftbilleddannelse. Kredit:City College i New York Forskning ved City College i New York viser, at kræftbilleddannelse kan forenkles ved en fotonisk pro
Team udvikler kræftbilleddannelseshjælp fra hestekastanjerMolekyler afledt af hestekastanjer hjælper kræftbilleddannelse. Kredit:City College i New York Forskning ved City College i New York viser, at kræftbilleddannelse kan forenkles ved en fotonisk pro -
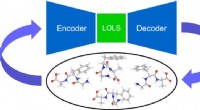 Ny maskinlæringstilgang letter molekylær konformersøgning i komplekse molekylerKredit:Aalto Universitet CEST-forskere udviklede en ny maskinlæringstilgang baseret på et lav-energi latent rum (LOLS) og densitets funktionel teori (DFT) til at søge efter molekylære konformere.
Ny maskinlæringstilgang letter molekylær konformersøgning i komplekse molekylerKredit:Aalto Universitet CEST-forskere udviklede en ny maskinlæringstilgang baseret på et lav-energi latent rum (LOLS) og densitets funktionel teori (DFT) til at søge efter molekylære konformere. -
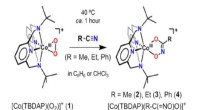 Nyt kompleks, der reagerer med nitril - en nøgle til at muliggøre nedregulering af kræftenzymerSyntetisk procedure for hydroximatocobaltkomplekser gennem reaktioner af et peroxocobaltkompleks 1 med nitriler. Kredit:DGIST Der er forskellige metalenzymer i menneskekroppen. Metalenzymer intera
Nyt kompleks, der reagerer med nitril - en nøgle til at muliggøre nedregulering af kræftenzymerSyntetisk procedure for hydroximatocobaltkomplekser gennem reaktioner af et peroxocobaltkompleks 1 med nitriler. Kredit:DGIST Der er forskellige metalenzymer i menneskekroppen. Metalenzymer intera -
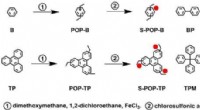 Et enkelt og universelt design til brændselscelleelektrolytDesign og syntese af POPer og sulfonerede POPer (S-POPer). Kredit:JAIST Forskere ved Japan Advanced Institute of Science and Technology (JAIST) og Dalian Institute of Chemical Physics, det kinesis
Et enkelt og universelt design til brændselscelleelektrolytDesign og syntese af POPer og sulfonerede POPer (S-POPer). Kredit:JAIST Forskere ved Japan Advanced Institute of Science and Technology (JAIST) og Dalian Institute of Chemical Physics, det kinesis
- Billede:Nordøst Kenya
- Ny beregningsmetode giver forskere mulighed for at designe cellulose nanokompositter med optimale eg…
- Hvad er fænomenet, hvor mikrobølgesignalet følger jordkruvaturen?
- Hvordan vil Google, Apple ryste bilforsikringsindustrien op?
- Hvad er den dyreste asteroide, der nogensinde er opdaget, og hvor meget er den værd?
- Hvad fugles holdning til affald fortæller os om deres evne til at tilpasse sig


