Hvorfor ionisk binding er retningsbestemt?
* Elektrostatisk attraktion: Ioniske bindinger dannes af den elektrostatiske tiltrækning mellem modsat ladede ioner. Disse attraktioner er ikke-retningsbestemte, hvilket betyder, at de virker i alle retninger omkring ion. Forestil dig en positivt ladet ion omgivet af en sfære med negativt ladede ioner - attraktionen er ens i alle retninger.
* gitterstruktur: Ioniske forbindelser danner krystallinske strukturer (som salt, NaCl). Denne struktur opstår, fordi de elektrostatiske kræfter arbejder for at minimere systemets samlede energi. Ionerne arrangerer sig i et gentagende mønster for at maksimere attraktioner og minimerer frastødninger. Denne struktur er ikke baseret på specifikke retninger mellem individuelle ioner.
I modsætning hertil er kovalent binding retningsbestemt:
* Elektrondeling: Kovalente bindinger dannes ved at dele elektroner mellem atomer. Denne deling skaber lokaliserede regioner med elektrondensitet mellem atomerne. Disse lokaliserede regioner dikterer obligationens retning.
Eksempel:
* natriumchlorid (NaCl): Natriumionen (Na+) og chloridion (Cl-) danner en kubisk gitterstruktur på grund af den ikke-retningsbestemte elektrostatiske attraktion.
* vand (H2O): De to hydrogenatomer er forbundet til iltatomet med kovalente bindinger. Disse bindinger er rettet på en bestemt måde, hvilket skaber den karakteristiske bøjede form af vandmolekylet.
Kortfattet: Ionisk binding er ikke-retningsbestemt på grund af arten af elektrostatisk tiltrækning. Kovalent binding er retningsbestemt på grund af den lokaliserede elektrondeling mellem atomer.
 Varme artikler
Varme artikler
-
 Ingeniør-klinikerteamet bruger aktive rynker til at holde syntetiske transplantater reneTop:En glat og statisk overflade efter eksponering for blod bliver tilsmudset med blodplader. Bund:En overflade, der rynker og flader gentagne gange, mens den udsættes for blod, modstår tilsmudsning.
Ingeniør-klinikerteamet bruger aktive rynker til at holde syntetiske transplantater reneTop:En glat og statisk overflade efter eksponering for blod bliver tilsmudset med blodplader. Bund:En overflade, der rynker og flader gentagne gange, mens den udsættes for blod, modstår tilsmudsning. -
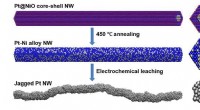 Ru overflader giver yderligere steder for energigenererende reaktioner i brændselscellerFlere aktive steder og mere overfladeareal på katalysatorer fremskynder den kemiske omdannelse af ilt og brint til vand og elektroner, generere elektricitet. Forskere udtænkte en ny synteserute for at
Ru overflader giver yderligere steder for energigenererende reaktioner i brændselscellerFlere aktive steder og mere overfladeareal på katalysatorer fremskynder den kemiske omdannelse af ilt og brint til vand og elektroner, generere elektricitet. Forskere udtænkte en ny synteserute for at -
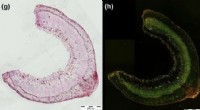 Selvhelbredende materialer inspireret af planterTværsnit af en Linum Drakkar stilk med et 26 dage gammelt sår parallelt med fibrene. Kredit:Cloé Paul-Victor, Albert-Ludwigs-Universitat Freiburg Forskere ved EPFLs Laboratory for Processing of Ad
Selvhelbredende materialer inspireret af planterTværsnit af en Linum Drakkar stilk med et 26 dage gammelt sår parallelt med fibrene. Kredit:Cloé Paul-Victor, Albert-Ludwigs-Universitat Freiburg Forskere ved EPFLs Laboratory for Processing of Ad -
 Forskere opdager kemisk reaktion, der bruger et overraskende molekyleKredit:CC0 Public Domain I mere end et årti i midten af det 20. århundrede, kemikere diskuterede præcis, hvordan karbokationer - molekyler med et positivt ladet kulstofatom - så ud. Det, der er
Forskere opdager kemisk reaktion, der bruger et overraskende molekyleKredit:CC0 Public Domain I mere end et årti i midten af det 20. århundrede, kemikere diskuterede præcis, hvordan karbokationer - molekyler med et positivt ladet kulstofatom - så ud. Det, der er
- Er en vesikel et organ eller organelle?
- Sådan fungerer mobile energistyringssystemer
- Hvad sker der med gravitationskraften mellem to objekter, hvis afstand dem er dicrygt?
- Cricket Habitat
- Tørke-resistente plantegener kunne accelerere udviklingen af vandforbrugende effektive afgrøder
- Hvordan opstod oceaner ifølge videnskabelige hypoteser?


