Hvorfor ionisk binding energisk gunstig mellem elementet i gruppe 1 2 6 og 7?
forståelse af det grundlæggende
* ioniske bindinger: Disse bindinger dannes, når et metal (typisk fra gruppe 1 og 2) mister elektroner for at blive en positivt ladet ion (kation), og en ikke -metal (typisk fra grupper 6 og 7) får disse elektroner til at blive en negativt ladet ion (anion). Den elektrostatiske tiltrækning mellem disse modsatte ladede ioner holder båndet sammen.
* Elektrostatisk attraktion: Den grundlæggende drivkraft bag ionisk bindingsdannelse er den stærke tiltrækning mellem modsatte afgifter. Denne attraktion frigiver energi, hvilket gør processen gunstig.
Hvorfor grupper 1, 2, 6 og 7?
* gruppe 1 og 2 (alkali og alkaliske jordmetaller): Disse metaller har kun en eller to valenselektroner (elektroner i den yderste skal). De mister let disse elektroner for at opnå en stabil, ædelgaskonfiguration. Dette er grunden til, at de danner kationer.
* gruppe 6 og 7 (chalcogens og halogener): Disse ikke -metaller har seks eller syv valenselektroner. De får elektroner for at afslutte deres octet og opnå en ædelgaskonfiguration og danner anioner.
Energifavorabilitet
1. lavere energistilstand: Ved at danne ioner opnår elementerne en mere stabil elektronkonfiguration, der er forbundet med lavere energi. Dette fald i energi er en drivkraft for bindingsdannelsen.
2. gitterenergi: Tiltrækningen mellem ioner i en fast krystalgitter er betydelig. Denne attraktion frigiver energi, kendt som gitterenergi. Jo større ladning af ionerne og jo mindre er deres størrelse, jo stærkere er gitterenergien.
Eksempel:
* Natrium (NA) fra gruppe 1 har en valenselektron. Det mister let dette elektron for at blive en Na+ -kation.
* Chlor (CL) fra gruppe 7 har syv valenselektroner. Det får en elektron til at blive en cl- anion.
* Den stærke elektrostatiske attraktion mellem Na+ og Cl- ioner danner en ionisk binding, der skaber NaCl (bordsalt). Den resulterende krystalgitter har betydelig gitterenergi.
Nøglepunkter:
* Ioniske bindinger er drevet af ønsket om at opnå stabile elektronkonfigurationer.
* Elektrostatisk tiltrækning mellem modsat ladede ioner frigiver energi, hvilket gør obligationen gunstig.
* Jo større afladning af ionerne og jo mindre er deres størrelse, jo stærkere er den ioniske binding.
I resumé skaber kombinationen af elementer fra grupper 1, 2, 6 og 7 ioniske bindinger på grund af de gunstige energiforandringer, der opstår, når de danner ioner og opnår stabile elektroniske konfigurationer. De resulterende ioniske forbindelser holdes sammen af stærke elektrostatiske kræfter, hvilket gør dem meget stabile.
Sidste artikelHvordan reagerer CO med Zno Thin Film?
Næste artikelHvorfor ionisk binding er retningsbestemt?
 Varme artikler
Varme artikler
-
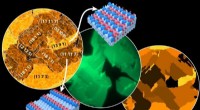 Anisotropi af overfladeoxiddannelse påvirker den forbigående aktivitet af en overfladereaktionFra venstre mod højre:Yndlingssteder for ilt:kort over Rh-oxidation, målt ved Scanning Photoelectron Microscopy (SPEM); in situ fotoemissionselektronmikroskopi (PEEM) af katalytisk hydrogenoxidation p
Anisotropi af overfladeoxiddannelse påvirker den forbigående aktivitet af en overfladereaktionFra venstre mod højre:Yndlingssteder for ilt:kort over Rh-oxidation, målt ved Scanning Photoelectron Microscopy (SPEM); in situ fotoemissionselektronmikroskopi (PEEM) af katalytisk hydrogenoxidation p -
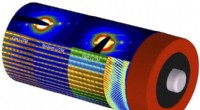 Kortlægning af batterimaterialer med atompræcisionAtomopløsning scanning transmission elektronmikroskopi billeder og elektron diffraktion mønstre, arrangeret på en gengivelse af et batteri, vise, hvordan strukturen af lithiumrige og manganrige over
Kortlægning af batterimaterialer med atompræcisionAtomopløsning scanning transmission elektronmikroskopi billeder og elektron diffraktion mønstre, arrangeret på en gengivelse af et batteri, vise, hvordan strukturen af lithiumrige og manganrige over -
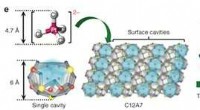 En usædvanlig stabil enkeltatomskatalysatorInteraktion mellem negativt ladede ioner og positivt ladede overfladehulrum i C12A7 til effektiv stabilisering af enkelt platinatomer. Kredit: Naturkommunikation Forskere ved Tokyo Institute of T
En usædvanlig stabil enkeltatomskatalysatorInteraktion mellem negativt ladede ioner og positivt ladede overfladehulrum i C12A7 til effektiv stabilisering af enkelt platinatomer. Kredit: Naturkommunikation Forskere ved Tokyo Institute of T -
 Ny tilgang til blødt materialestrøm kan give vej til nye materialer, katastrofeforudsigelseEn ny undersøgelse fra ingeniører ved University of Illinois, Urbana-Champaign bruger enkle eksperimenter til at forklare, hvordan en bedre forståelse af flydende bevægelse af bløde materialer vil hjæ
Ny tilgang til blødt materialestrøm kan give vej til nye materialer, katastrofeforudsigelseEn ny undersøgelse fra ingeniører ved University of Illinois, Urbana-Champaign bruger enkle eksperimenter til at forklare, hvordan en bedre forståelse af flydende bevægelse af bløde materialer vil hjæ
- Forskere opdager, at gener styres af nanofodbolde
- En ny rekonfigurationsstrategi for modulære robotter inspireret af origami-foldning
- Alberta trækker sig ud af CO2-afgiftsinitiativet efter pipeline-kendelse
- Hvad er hovedsekvensfasen af en stjerne?
- Hvordan sange om havene øger miljøbevidstheden
- Hvem var den første til at bevise den geocentriske teori, ikke?


