Syrer kombineres med aktive metaller for at afgive H2?
Her er en sammenbrud af hvorfor:
* aktive metaller: Dette er metaller, der let mister elektroner og danner positive ioner (kationer). Eksempler inkluderer:
* Gruppe 1 (alkalimetaller):lithium (Li), natrium (NA), kalium (K) osv.
* Gruppe 2 (alkaliske jordmetaller):magnesium (Mg), calcium (CA), barium (BA) osv.
* Nogle overgangsmetaller:zink (Zn), jern (Fe), aluminium (AL) osv.
* syrer: Dette er stoffer, der donerer protoner (H⁺ioner) i opløsning. Almindelige eksempler inkluderer:
* Saltsyre (HCL)
* Svovlsyre (H₂so₄)
* Salpetersyre (hno₃)
reaktionen:
Når et aktivt metal reagerer med en syre, mister metalatomerne elektroner og danner positive ioner (kationer). Disse elektroner accepteres derefter af hydrogenionerne (H⁺) fra syren, der danner brintgas (H₂).
Generel ligning:
Metal + syre → salt + brintgas
Eksempel:
Zink (Zn) reagerer med saltsyre (HCI) for at producere zinkchlorid (ZnCl₂) og brintgas (H₂):
Zn (S) + 2HCI (aq) → Zncl₂ (aq) + H₂ (g)
Vigtige noter:
* Ikke alle metaller reagerer med alle syrer. Nogle metaller er mindre reaktive og reagerer muligvis ikke med visse syrer.
* Reaktionen kan være kraftig og frigive varme, afhængigt af det specifikke metal og syre.
* Den producerede brintgas er brandfarlig og bør håndteres med forsigtighed.
 Varme artikler
Varme artikler
-
 Forskere udvikler ny teknologi, der kan fremskynde kommercialiseringen af brændselscellekøretøj…Et hold af UD-ingeniørfakultetets medlemmer og afdelingsledere samlede deres forskningsgrupper til en brændselscelle-innovation. Denne illustration inkluderer professorerne Ajay K. Prasad, Suresh G. A
Forskere udvikler ny teknologi, der kan fremskynde kommercialiseringen af brændselscellekøretøj…Et hold af UD-ingeniørfakultetets medlemmer og afdelingsledere samlede deres forskningsgrupper til en brændselscelle-innovation. Denne illustration inkluderer professorerne Ajay K. Prasad, Suresh G. A -
 Forskere opnår hidtil uset kontrol over polymergitreKovalente organiske rammer (COFer) tilbyder en unik kombination af egenskaber, der viser lovende for vandrensning, energilagring og elektronisk udstyr. Kredit:Northwestern University Syntetiske po
Forskere opnår hidtil uset kontrol over polymergitreKovalente organiske rammer (COFer) tilbyder en unik kombination af egenskaber, der viser lovende for vandrensning, energilagring og elektronisk udstyr. Kredit:Northwestern University Syntetiske po -
 Neutroner låser op for egenskaber ved nyt porøst metalhydrid til mulige nye energilagringsapplikat…Stående ved WAND2 instrumentet, forskere (fra venstre mod højre) Michael Heere og Yaroslav Filinchuk med ORNL-strålelinjeforskerne Matthias Frontzek og Simon Kimber. Kredit:ORNL/Jeremy Rumsey Adsk
Neutroner låser op for egenskaber ved nyt porøst metalhydrid til mulige nye energilagringsapplikat…Stående ved WAND2 instrumentet, forskere (fra venstre mod højre) Michael Heere og Yaroslav Filinchuk med ORNL-strålelinjeforskerne Matthias Frontzek og Simon Kimber. Kredit:ORNL/Jeremy Rumsey Adsk -
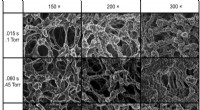 Forskere rapporterer om tosidede Janus-membranapplikationerDisse er overflade-SEM-billeder af Janus-membranfronter dyrket med 150, 200 og 300 cyklusser ved .015, 06 og 0,15 sekunder eksponeringer. En generel tendens til hurtigere nukleering og efterfølgende b
Forskere rapporterer om tosidede Janus-membranapplikationerDisse er overflade-SEM-billeder af Janus-membranfronter dyrket med 150, 200 og 300 cyklusser ved .015, 06 og 0,15 sekunder eksponeringer. En generel tendens til hurtigere nukleering og efterfølgende b


