Hvad er fire måder, et atom kan danne bindinger med andre atomer?
1. ionisk binding: Dette sker, når et atom donerer et elektron til et andet atom. Dette resulterer i, at det ene atom bliver positivt ladet (en kation) og den anden bliver negativt ladet (en anion). Den elektrostatiske tiltrækning mellem disse modsatte ladede ioner holder dem sammen.
2. kovalent binding: I kovalent binding, atomer del Elektroner. Denne deling kan være ens (ikke -polær kovalent binding) eller ulig (polær kovalent binding), hvor et atom har et stærkere træk på de delte elektroner. De delte elektroner skaber en stærk attraktion mellem atomerne.
3. Metallisk binding: Denne type binding forekommer kun mellem metalatomer. Det involverer et "hav" af delokaliserede elektroner, der ikke er bundet til noget bestemt atom. Dette hav af elektroner giver metaller mulighed for at udføre elektricitet og varme godt og giver dem deres karakteristiske glans og formbarhed.
4. Hydrogenbinding: Selvom det ikke er en "sand" binding på samme måde som de andre, er hydrogenbinding en stærk type intermolekylær tiltrækning. Det forekommer mellem et hydrogenatom kovalent bundet til et stærkt elektronegativt atom (som ilt, nitrogen eller fluor) og et ensomt par elektroner på et tilstødende elektronegativt atom. Denne attraktion spiller en vigtig rolle i egenskaberne ved vand og andre biologiske molekyler.
Sidste artikelEr nuklear fusion en gasvæske eller fast?
Næste artikelHvad er række af methylorange?
 Varme artikler
Varme artikler
-
 Ny undersøgelse afslører ladningsoverførsel ved grænsefladen mellem spineloxid og ceriumoxid und…Resultaterne af denne forskning er blevet offentliggjort i februar 2021-udgaven af ACS katalyse og vist på forsiden af den trykte udgave. Kredit:UNIST En nylig undersøgelse har afsløret årsage
Ny undersøgelse afslører ladningsoverførsel ved grænsefladen mellem spineloxid og ceriumoxid und…Resultaterne af denne forskning er blevet offentliggjort i februar 2021-udgaven af ACS katalyse og vist på forsiden af den trykte udgave. Kredit:UNIST En nylig undersøgelse har afsløret årsage -
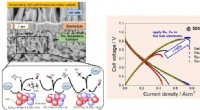 Forskere udvikler højtydende keramisk brændselscelle, der fungerer på butangasNår nikkelkatalysatoren i keramiske brændselsceller bruges sammen med kulbrintebrændstoffer, såsom metan, propan, og butan, det kulstof, der dannes under brændstofomdannelsen, aflejres på overfladen a
Forskere udvikler højtydende keramisk brændselscelle, der fungerer på butangasNår nikkelkatalysatoren i keramiske brændselsceller bruges sammen med kulbrintebrændstoffer, såsom metan, propan, og butan, det kulstof, der dannes under brændstofomdannelsen, aflejres på overfladen a -
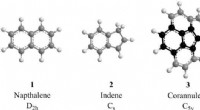 Interstellar kemi:lavtemperaturgasfasedannelse af inden i det interstellare mediumDe enkleste repræsentanter for to-ring PAHer, der bærer to seks-leddede (naphthalen, C10H8; 1) og en seks- sammen med en fem-leddet ring (indene, C9H8; 2). Mens hydrogenabstraktion-vinylacetylen-addit
Interstellar kemi:lavtemperaturgasfasedannelse af inden i det interstellare mediumDe enkleste repræsentanter for to-ring PAHer, der bærer to seks-leddede (naphthalen, C10H8; 1) og en seks- sammen med en fem-leddet ring (indene, C9H8; 2). Mens hydrogenabstraktion-vinylacetylen-addit -
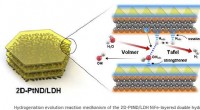 Dobbeltlagskatalysator genererer mere brintKredit:Yu-Rim Hong et al. Hydrogen-genererende katalysatorer kan skabe synergistiske effekter, når forskellige materialer er lagdelt med deres unikke egenskaber. For nylig har et koreansk forskerho
Dobbeltlagskatalysator genererer mere brintKredit:Yu-Rim Hong et al. Hydrogen-genererende katalysatorer kan skabe synergistiske effekter, når forskellige materialer er lagdelt med deres unikke egenskaber. For nylig har et koreansk forskerho
- Forskere finder en måde at lave glas på, der er anti-fogging, selvrensende og fri for blænding
- DNA byggesæt til nanomotorer
- Er han et grundstof eller en forbindelse?
- Hvad er mere på jorden rigeligt kulstof 12 eller 14?
- Hvad skete der med den kinetiske energi fra partikler i en prøvegas, når temperaturen stiger?
- Hvordan kan musik, dans og kunst være med til at forbedre luftforureningen?


