Har kulbrinte lange kæder et højt eller lavt kogepunkt?
* stærkere van der Waals Forces: Lange carbonhydridkæder har et større overfladeareal sammenlignet med kortere kæder. Dette større overfladeareal fører til stærkere London -spredningskræfter (en type van der Waals Force). Disse kræfter stammer fra midlertidige udsving i elektronfordeling inden for molekylet, hvilket skaber midlertidige dipoler, der tiltrækker nabolande molekyler.
* mere energi krævet for at overvinde intermolekylære kræfter: Jo stærkere de intermolekylære kræfter, jo mere energi kræves for at overvinde dem og få stoffet til at skifte fra en væske til en gas (kogning).
Kortfattet: Jo længere kulbrintekæden er, jo stærkere kræfter van der Waals mellem molekylerne, hvilket fører til et højere kogepunkt.
Sidste artikelHvad er opløst renhed?
Næste artikelHvad er kemisk specielt ved neutralisering?
 Varme artikler
Varme artikler
-
 Detronisering af elektrokatalysatorer til brintproduktion med billigt alternativt materialeElektrokemisk vandopdeling kræver meget aktiv, let fremstillet, og omkostningseffektive elektrokatalysatorer til oxygenudviklingsreaktionen (OER). Et jern (Fe)/calcium (Ca)-baseret bimetaloxid, Cafe
Detronisering af elektrokatalysatorer til brintproduktion med billigt alternativt materialeElektrokemisk vandopdeling kræver meget aktiv, let fremstillet, og omkostningseffektive elektrokatalysatorer til oxygenudviklingsreaktionen (OER). Et jern (Fe)/calcium (Ca)-baseret bimetaloxid, Cafe -
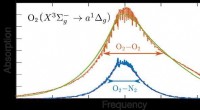 Forskere opdager, hvordan kolliderende iltmolekyler absorberer lysFigur:Eksperimentelle og teoretiske spektre for lysabsorption på grund af kollision af ilt (O2) molekyler med andre iltmolekyler og med nitrogen (N2) molekyler. Som vist her, absorptionen på grund af
Forskere opdager, hvordan kolliderende iltmolekyler absorberer lysFigur:Eksperimentelle og teoretiske spektre for lysabsorption på grund af kollision af ilt (O2) molekyler med andre iltmolekyler og med nitrogen (N2) molekyler. Som vist her, absorptionen på grund af -
 Kunstig fotosyntese kan omdanne ubrugelig kuldioxid til myresyre, der bruges i industrienNaturlig fotosyntese er ikke altid særlig effektiv. Når videnskabsmænd efterligner det, de forsøger at gøre processerne meget mere effektive. Kredit:Colourbox Med energi fra solen, et særligt enzy
Kunstig fotosyntese kan omdanne ubrugelig kuldioxid til myresyre, der bruges i industrienNaturlig fotosyntese er ikke altid særlig effektiv. Når videnskabsmænd efterligner det, de forsøger at gøre processerne meget mere effektive. Kredit:Colourbox Med energi fra solen, et særligt enzy -
 Bløde dobbeltgyroider er unikke, men ufuldkommen, krystallerRice University materialeforsker Ned Thomas har en model af den blokcopolymer, han og hans laboratorium skabte for at se, om de kubiske strukturer indeni var perfekte eller ej. Undersøgelse med et ele
Bløde dobbeltgyroider er unikke, men ufuldkommen, krystallerRice University materialeforsker Ned Thomas har en model af den blokcopolymer, han og hans laboratorium skabte for at se, om de kubiske strukturer indeni var perfekte eller ej. Undersøgelse med et ele
- Hvad er den kemiske ligning for reaktion af hexen og bromvand?
- Hvad ville to regioner med det samme klima have til fælles?
- Hvad er egenskaberne ved lysbølger?
- Bedre kundepleje på Twitter fører til næsten 20 % stigning i kundetilfredsheden
- Snap frigiver nye briller, der optager 3D-billeder
- Tv-til-telefon-opstart skaber $ 1 mia. Hollywood -opbakning


