Hvorfor er neon og andre ædle gasser så ureaktive?
* fuld ydre skal: Noble gasser har en fuld ydre skal af elektroner, som er den mest stabile elektronkonfiguration. Dette betyder, at deres yderste energiniveau er komplet uden ledige stillinger til yderligere elektroner.
* Lav elektronegativitet: De har meget lav elektronegativitet, hvilket betyder, at de har ringe tendens til at tiltrække elektroner.
* Høj ioniseringsenergi: De har høj ioniseringsenergi, hvilket betyder, at det kræver en masse energi for at fjerne et elektron fra deres atomer.
hvorfor dette gør dem ureaktive:
* Ingen grund til at vinde eller miste elektroner: Da deres ydre skal er fuld, behøver de ikke at vinde eller miste elektroner for at opnå stabilitet.
* Ingen stærk tiltrækning til andre atomer: Deres lave elektronegativitet og mangel på ledige rum i deres ydre skal betyder, at de ikke let danner bindinger med andre atomer.
* vanskelige at danne ioner: Deres høje ioniseringsenergi gør det vanskeligt at fjerne elektroner og forhindre dem i let at danne positive ioner.
Kortfattet: Den fulde ydre skal af elektroner, lav elektronegativitet og høj ioniseringsenergi af ædelgasser gør dem meget ureaktive og resistente over for dannelse af kemiske bindinger. Dette er grunden til, at de ofte omtales som "inerte gasser."
Sidste artikelHvor beregner PH for en løsning?
Næste artikelHvad er væsken i en homogen blanding?
 Varme artikler
Varme artikler
-
 Katalyserer ammoniakdannelse ved lavere temperaturer med rutheniumMetallet ruthenium, understøttet med lanthanidoxyhydrider, kan effektivt katalysere syntesen af ammoniak ved en meget lavere temperatur end den traditionelle tilgang. Kredit:Tokyo Tech Nitrogen
Katalyserer ammoniakdannelse ved lavere temperaturer med rutheniumMetallet ruthenium, understøttet med lanthanidoxyhydrider, kan effektivt katalysere syntesen af ammoniak ved en meget lavere temperatur end den traditionelle tilgang. Kredit:Tokyo Tech Nitrogen -
 Levende cellemembraner kan selvsortere deres komponenter ved afblandingFaseadskillelse i en syntetisk membran. Kredit:Caitlin Cornell/University of Washington Celler - byggestenene i vores kroppe - er indkapslet af membraner. Det samme gælder de specialiserede rum i
Levende cellemembraner kan selvsortere deres komponenter ved afblandingFaseadskillelse i en syntetisk membran. Kredit:Caitlin Cornell/University of Washington Celler - byggestenene i vores kroppe - er indkapslet af membraner. Det samme gælder de specialiserede rum i -
 En undersøgelse af katalysatorer til syntetisering af polyethylen med ultrahøj molekylvægtKredit:RUDN Universitet En kemiker fra RUDN University som en del af et team af forskere har syntetiseret nye højaktive katalysatorer til fremstilling af polyethylen med ultrahøj molekylvægt, som
En undersøgelse af katalysatorer til syntetisering af polyethylen med ultrahøj molekylvægtKredit:RUDN Universitet En kemiker fra RUDN University som en del af et team af forskere har syntetiseret nye højaktive katalysatorer til fremstilling af polyethylen med ultrahøj molekylvægt, som -
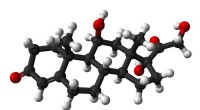 Bærbar enhed måler kortisol i svedBold-og-stik-model af cortisol (hydrocortison) molekylet. Kredit:Public Domain Hormonet kortisol stiger og falder naturligt i løbet af dagen og kan stige som reaktion på stress, men nuværende meto
Bærbar enhed måler kortisol i svedBold-og-stik-model af cortisol (hydrocortison) molekylet. Kredit:Public Domain Hormonet kortisol stiger og falder naturligt i løbet af dagen og kan stige som reaktion på stress, men nuværende meto
- Hvad ville der ske, hvis der ikke var nogen formørkelse?
- Ny økonomisk vandspaltningskatalysator, Ru@C2N
- Italiensk fragtskib synker ud for Frances Atlanterhavskyst efter brand
- Kan heliumatom lide at b e af sig selv?
- Hvad er praktisk videnskab?
- Forskellen mellem kvalitative og kvantitative træk i genetik


