Hvad er HCH -bindingsvinklen for methanol?
Her er hvorfor:
* Hybridisering: Carbonatomet i methanol er SP3 hybridiseret. Dette betyder, at det har fire elektrondomæner (et for C-O-bindingen, tre for C-H-bindingerne), der arrangerer sig tetrahedralt.
* Ideel vinkel: I et ideelt tetrahedralt arrangement er bindingsvinklen 109,5 grader.
* let afvigelse: De ensomme par elektroner på iltatomet udøver en lidt større frastødende kraft end bindingspar, hvilket forårsager en let komprimering af HCH -bindingsvinklen i methanol, hvilket resulterer i en værdi lidt mindre end de ideelle 109,5 grader.
Derfor er HCH -bindingsvinklen i methanol ca. 108,9 grader.
Sidste artikelIndeholder alle celler lignende kemikalier?
Næste artikelDiskussion af et eksperiment smeltepunkt?
 Varme artikler
Varme artikler
-
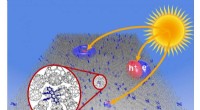 Molekylære vibrationer reducerer den maksimalt opnåelige fotovoltage i organiske solcellerIllustration af generation af ladningspar (excitoner), forløberne til gratis ladningsbærere i det aktive lag af en organisk solcelle. Kredit:Technische Universitaet Dresden Forskere ved TU Dresden
Molekylære vibrationer reducerer den maksimalt opnåelige fotovoltage i organiske solcellerIllustration af generation af ladningspar (excitoner), forløberne til gratis ladningsbærere i det aktive lag af en organisk solcelle. Kredit:Technische Universitaet Dresden Forskere ved TU Dresden -
 IBM annoncerer AI-baseret kemilaboratorium:RoboRXNKredit:Pixabay/CC0 Public Domain IBM har annonceret på sin blogside udviklingen af et AI/cloud-baseret kemilaboratorium ved navn RoboRXN. Dens formål er at hjælpe kemikere med at udvikle nye mat
IBM annoncerer AI-baseret kemilaboratorium:RoboRXNKredit:Pixabay/CC0 Public Domain IBM har annonceret på sin blogside udviklingen af et AI/cloud-baseret kemilaboratorium ved navn RoboRXN. Dens formål er at hjælpe kemikere med at udvikle nye mat -
 Tilslutning for at producere miljøvenlig bioplastKredit:Pixabay/CC0 Public Domain Bioplastik - bionedbrydelig plast fremstillet af biologiske stoffer i stedet for petroleum - kan fremstilles på en mere økonomisk og miljøvenlig måde ud fra biprod
Tilslutning for at producere miljøvenlig bioplastKredit:Pixabay/CC0 Public Domain Bioplastik - bionedbrydelig plast fremstillet af biologiske stoffer i stedet for petroleum - kan fremstilles på en mere økonomisk og miljøvenlig måde ud fra biprod -
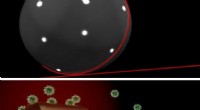 At sætte fokus på livets maskineriEn sensor på en sensor:Laserlys (rødt) skinner (øverst) ind i en mikroperle af glas, som en guld nanorod er fastgjort til. Laserlyset løber rundt om indersiden af mikroperlen og er koncentreret om g
At sætte fokus på livets maskineriEn sensor på en sensor:Laserlys (rødt) skinner (øverst) ind i en mikroperle af glas, som en guld nanorod er fastgjort til. Laserlyset løber rundt om indersiden af mikroperlen og er koncentreret om g
- Bremse urværket
- Forskere bygger verdens mindste vandflaske
- Den type bjerg, der dannes, når klippelagene presses sammen og skubbes opad?
- Hvorfor hollænderne bliver ved med at holde fast i billedet af Black Pete
- Hvor sikker er GSM -mobiltelefonnetværket?
- Hvad er koefficienten for oxygen i balanceret kemisk ligningsforbrænding af heptans C7H16?


