At sætte fokus på livets maskineri
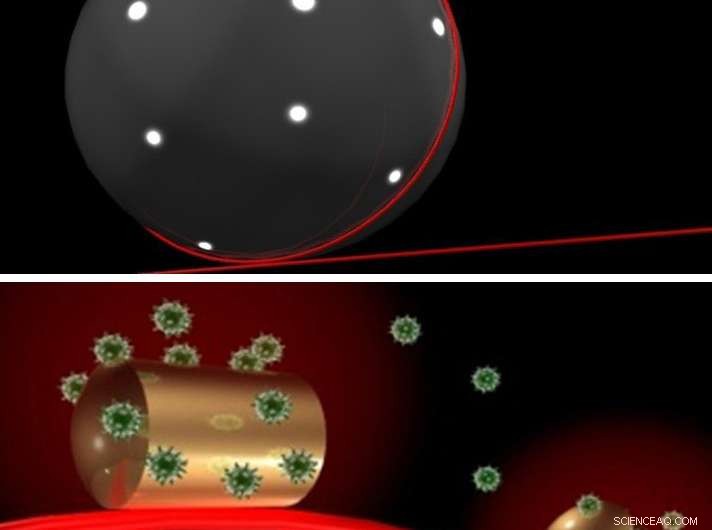
En sensor på en sensor:Laserlys (rødt) skinner (øverst) ind i en mikroperle af glas, som en guld nanorod er fastgjort til. Laserlyset løber rundt om indersiden af mikroperlen og er koncentreret om guldstangen, hvortil biomolekyler (i dette tilfælde proteiner) kan binde sig (nederst). Når molekylet bevæger sig, ændre i hvilken grad det overlapper med lysfeltet, sensoren producerer et signal. Dette gør det muligt at observere enzymer og enzymbevægelser uden brug af en markør. Kredit:Frank Vollmer / Science Advances
Forskere fra Max Planck Institute for the Science of Light i Erlangen har udviklet en teknik til direkte at observere, hvordan enzymer og andre biomolekyler udfører deres arbejde, med potentielt betydelige medicinske og videnskabelige fordele. Ved at bruge denne teknik, de har, for første gang med kun lys og uden en markør, observerede konformationelle ændringer i DNA-polymerase, enzymet, der er ansvarligt for at replikere DNA. Fordi teknikken også kan bruges til at studere, hvordan enzymer udfører deres arbejde, det kunne hjælpe med at identificere nye mekanismer for lægemiddeludvikling.
Når biologer ser gennem et moderne mikroskop, det, de ser, er lidt ligesom det, du kunne se, hvis du skulle se langs en motorvej om natten:køretøjer er kun synlige ved deres forlygter, og det er umuligt at sige, om forlygterne tilhører en bil eller en lastbil, eller om en parkeret bil åbner døren. På nuværende tidspunkt Biologer kan kun observere enzymer, der udfører deres arbejde indirekte. De vedhæfter fluorescerende farvestoffer til individuelle komponenter af biomolekyler og ser derefter lyspunkterne bevæge sig rundt under et mikroskop. De kan meget lidt se, hvordan enzymets form ændrer sig. Ud over, at have et farvestof molekyle knyttet til det betyder, at enzymet, de ser, ikke er i sin naturlige tilstand. Det kan ikke udelukkes, at sådanne farvestofmolekyler kan påvirke enzymets funktion.
Et team af forskere ledet af Frank Vollmer, indtil for nylig leder af en forskningsgruppe ved Max Planck Institute for the Science of Light og nu professor ved University of Exeter, har, imidlertid, udviklet en teknik, der gør dem i stand til at observere enzymer uden at påsætte en fluorescerende markør.
En nanorod koncentrerer lyset på et område på blot nogle få nanometer
Deres mikroskopisk lille instrument er faktisk en sensor på en sensor. En guld nanorod omkring 10 nanometer i diameter og 40 nanometer lang er fastgjort til en glasmikroperle med en diameter på omkring 80 mikrometer (1 mikrometer =1/1000 millimeter). En lys bølge, produceret af en laser, sendes skitrende rundt om den indvendige kant af denne mikroperle. Fordi denne bølge overlapper kanten af mikroperlen meget lidt, den interagerer med den vedhæftede nanorod.

Give en hånd:Sensoren er i stand til at detektere, når et DNA-polymerasemolekyle binder sig til guld-nanorod af en plasmonisk nanosensor og syntetiserer en DNA-streng. Under denne proces åbner og lukker enzymet sig som en hånd, ændrer i hvilken grad den overlapper med lyspletten på guldnanostangen. Dette ændrer bølgelængden af lyset, der zoomer rundt om indersiden af mikroperlen. Forskerne bruger denne ændring i bølgelængde som et mål for omfanget af overlapningen. Kredit:Frank Vollmer / Science Advances
Denne interaktion starter ret svagt, men mikroperlen fungerer som et hviskende galleri:I en rotunde, et ord hvisket langs væggen kan tydeligt høres på den anden side, fordi lydbølgen følger væggens kurve i stedet for at blive spredt i alle retninger. På samme måde, lysbølgen, der går rundt og rundt om indersiden af mikroperlen, passerer guldnanoroden tusindvis af gange på ekstremt kort tid, forstærker interaktionen med nanorod.
Nanorod trækker lyset ud, der overlapper kanten af mikroperlen yderligere. Resultatet er et koncentreret område af lys som en spotlight, der er omtrent samme størrelse som stangen, altså kun et par nanometer i diameter. Hvis et enzym eller et andet molekyle derefter binder til guld nanorod, den er badet i dette rampelys. Signalet, som sensoren producerer, afhænger af det molekyle, der er placeret i rampelyset, og hvordan det bevæger sig i dette lys. Dette giver forskerne mulighed for at undersøge og registrere bevægelserne af et enkelt enzymmolekyle.
Forskellige signaler for forskellige enzymkonformationer
Teknikken er baseret på et fænomen kendt som plasmonics. Anvendes på små metalstrukturer såsom nanorods, plasmonics tillader lyset at blive koncentreret på et område på blot nogle få nanometer. "Dette giver os mulighed for at skalere lyset ned til størrelsen af et enzym, " forklarer Frank Vollmer fra Max Planck Institute for the Science of Light i Erlangen. Og endnu længere – det er endda lykkedes forskerne i Erlangen at bruge deres teknik til at sondere individuelle ioner.
I et eksperiment, fysikerne knyttet enzymet DNA-polymerase til deres sensor og forsøgte derefter at registrere, hvordan det bevæger sig. DNA-polymerase ligner en hånd, der griber et rør - røret er i dette tilfælde den DNA-streng, den behandler. Denne "hånd" giver et andet signal, når den er åben, og når den er lukket, da dette ændrer størrelsen af overlapningen mellem lyspletten og enzymet. Dette har gjort det muligt for forskerne at registrere, hvordan enzymet åbner og lukker i realtid. "Yderligere forfining af vores teknik skulle give os mulighed for at gøre ting som direkte at registrere syntese af en DNA-streng af polymeraseenzymet, " forklarer Vollmer. Biokemikere ville så være i stand til i realtid at observere, hvordan enzymet kopierer genetisk information og endda bruge signalet produceret af nanosensoren til DNA-sekventering.

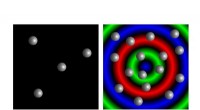
Påvisning af individuelle ioner:Sensoren er så følsom, at signalet endda viser, når en enkelt ion binder sig til spidsen af nanorod (vist i skematisk form her) fastgjort til glasmikroperlen. Kredit:Frank Vollmer / Nature Photonics
Eksperimenter med den nye teknik har været i stand til at observere mere end blot, hvordan enzymer bevæger sig. "Vi har brugt det til at observere temperaturafhængigheden af enzymaktivitet, " forklarer Frank Vollmer. Dette giver en nem måde at udføre termodynamiske undersøgelser på. Sådanne undersøgelser kan give information om karakteristika såsom aktiveringsenergien af et enzym, forklarer fysikeren. Aktiveringsenergien er et mål for effektiviteten af disse biologiske katalysatorer.
Nanosensoren kan bruges til at observere kemiske reaktioner
For at demonstrere, hvor små de partikler, der kan detekteres ved hjælp af en plasmonisk nanosensor, kan være, forskerne brugte det til at observere individuelle ioner (elektrisk ladede atomer). "Vi var overraskede over, at dette overhovedet var muligt, " siger Vollmer. De zink- og kviksølvioner, de brugte, er kun omkring en tiendedel af en nanometer i størrelse - mindre end en tusindedel af bølgelængden af det anvendte lys. Det er, imidlertid, muligt at producere en lys plet for enden af en nanorod, som er i stand til at sondere så små dimensioner. "Det handler ikke om at identificere individuelle ioner, " understreger Vollmer. Forskerne var i stand til at sikre, at præcis én ion fæstede sig til enden af nanorod ved at variere koncentrationen af ioner i opløsning. At komme ned på denne skala kunne give biologer mulighed for at studere ionkanalfunktion. Ionkanaler omfatter bl.a. for eksempel, proteiner indlejret i nervecellemembraner, som er ansvarlige for signaltransmission langs nerven.
Brug af nanosensoren udviklet af Frank Vollmers team er ikke begrænset til at visualisere biokemiske processer, der involverer enzymer og andre proteiner. Det kan også bruges til at observere kemiske reaktioner mellem individuelle molekyler og overfladen af guld nanorod. "Ved at bruge denne teknik, vi kan, for eksempel, opdage og analysere interaktionsmekanismer, " forklarer Frank Vollmer. Tidsforløbet for disse interaktioner kan give indsigt i, hvordan forskellige molekyler binder sig til overfladen af guldnanoroden.
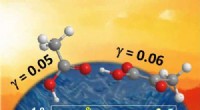
For at demonstrere dette, forskerne studerede to typer molekyler, en indeholdende en amingruppe, en indeholdende en thiolgruppe. "Det viser sig, at de to grupper reagerer med guldets overflade via forskellige mekanismer, " forklarer Vollmer. Hvorimod amingrupperne binder sig til guldatomer, der rager ud fra overfladen, thiolgrupperne binder sig kun til atomer, der er helt indlejret i overfladen.

Kræsne molekyler:Molekyler med aminogrupper (lyserøde) binder sig til guldatomer, der rager ud fra overfladen af nanorod. Derimod molekyler med thiolgrupper (blå) binder til guldatomer indlejret i overfladen. Om de adsorberede molekyler reagerer med hinanden afhænger af at have de rigtige reaktionsbetingelser, (specifikt pH, ionstyrke og temperatur). Fordi reaktionen er synlig i sensorsignalet, den plasmoniske nanosensor kan bruges til hurtigt at optimere overfladereaktioner. Kredit:Frank Vollmer / Advanced Materials
Forskerne observerede også reaktioner mellem de forskellige molekyler. "Dette gør det muligt for kemikere at teste og optimere reaktionsbetingelserne i realtid, " siger Vollmer. Brugen af denne guld nanorod lysplet er ikke begrænset til at studere kemiske reaktioner, dog – den kan også bruges til at kontrollere dem. Ved at øge intensiteten af lyset i den koncentrerede lysplet, forskerne gjorde det muligt for en kviksølvion at binde sig til overfladen af guldnanoroden. Intensiteten af lyset i lyspletten øger energien af elektronerne i guldstaven, så de er i stand til at reagere med kviksølvionerne. Dette giver et stabilt amalgam af guld og kviksølv. De to elementer forbliver sammensmeltet, selv når lyspletten forsvinder, da reaktionen frembringer en relativt stabil kovalent binding mellem et guldatom og et kviksølvatom.
"Kontrol af reaktioner og enzymaktivitet på den plasmoniske biosensor er et meget interessant område for fremtidig forskning, " siger Vollmer. Lyspletten kan også bruges som en optisk pincet til midlertidigt at fiksere enkelte biomolekyler til sensoren til optisk analyse.
Indsigt i funktionsfejl i livets maskineri
Vollmers teams fremtidsvision er at kunne scanne molekyler – både biomolekyler og syntetiske molekyler – atom for atom. "Ved at bruge forskellige lyskilder med forskellige bølgelængder og polariseringer, det er i princippet muligt at ændre i hvilken grad lyset overlapper molekylet og sondere forskellige domæner af det samme molekyle, " forklarer Vollmer. En molekylær scanner af denne type kan muligvis observere en proces fra en række forskellige vinkler og med meget korte intervaller. Et højopløsningskort over en sådan proces ville forbedre vores forståelse af det molekylære maskineri betydeligt. Biologer ville endda være i stand til i detaljer at observere, hvordan sådanne strukturer ændrer sig over perioder, der spænder fra nanosekunder til flere timer.Den plasmoniske biosensor øger også muligheden for et automatiseret laboratorium, der ikke er større end en fingernegl, som scanner en prøve, protein for protein, at diagnosticere sygdom på molekylært niveau.
Skulle det i fremtiden blive muligt at bruge plasmoniske nanosensorer til at se, hvordan enzymer ændrer deres form, dette kunne sætte klinikere i stand til bedre at forstå, hvordan funktionsfejl i livets maskineri forårsager sygdomme som Alzheimers, som er forbundet med ændringer i enzymstruktur. En bedre forståelse af sådanne processer kunne endda give nye tilgange til behandling.
 Varme artikler
Varme artikler
-
 Forskere udvikler selvdrevet mikrofluidisk ark, der omslutter, klapper og krybEn animation af udpakningen af et katalse-belagt blomsterlignende ark omkring en kapsel. Sorte pile angiver retningen og størrelsen af flowfeltet i opløsningen. Kredit:Abhrajit Laskar Det tryl
Forskere udvikler selvdrevet mikrofluidisk ark, der omslutter, klapper og krybEn animation af udpakningen af et katalse-belagt blomsterlignende ark omkring en kapsel. Sorte pile angiver retningen og størrelsen af flowfeltet i opløsningen. Kredit:Abhrajit Laskar Det tryl -
 Carboxylsyrer opfører sig som supersyrer på overfladen af vandCarboxylsyrer opfører sig som supersyrer på luftsiden af vandoverfladen. Kredit:M. Guzman Atmosfæriske partikler med højt vandindhold også kendt som aerosoldråber findes i vid udstrækning på Jor
Carboxylsyrer opfører sig som supersyrer på overfladen af vandCarboxylsyrer opfører sig som supersyrer på luftsiden af vandoverfladen. Kredit:M. Guzman Atmosfæriske partikler med højt vandindhold også kendt som aerosoldråber findes i vid udstrækning på Jor -
 Ny forskning afslører potentiale for syntetiske materialesystemer, der kan tælle og fornemme deres…Modellerede mikrokapsler viser quorum sensing-adfærd. En lille samling mikrokapsler forbliver i dvale (til venstre), mens en stor, overfyldt befolkning udviser svingninger i kemisk aktivitet (til højr
Ny forskning afslører potentiale for syntetiske materialesystemer, der kan tælle og fornemme deres…Modellerede mikrokapsler viser quorum sensing-adfærd. En lille samling mikrokapsler forbliver i dvale (til venstre), mens en stor, overfyldt befolkning udviser svingninger i kemisk aktivitet (til højr -
 Sådan huskes afgifterne for polyatomiske joner <p> <p> Ioner i kemi kan være et enkelt ladet atom,…Skriv hvert atom i ionen med sin Lewis dot-struktur. Overvej for eksempel ammoniumionen, der har et nitrogenatom og fire hydrogenatomer. Kvælstofatom udtrykkes med et N omgivet af fem prikker for at r
Sådan huskes afgifterne for polyatomiske joner <p> <p> Ioner i kemi kan være et enkelt ladet atom,…Skriv hvert atom i ionen med sin Lewis dot-struktur. Overvej for eksempel ammoniumionen, der har et nitrogenatom og fire hydrogenatomer. Kvælstofatom udtrykkes med et N omgivet af fem prikker for at r
- En metallignende kvantegas:En banebrydende platform til kvantesimulering
- Vær sikker, og fornuftig, da Silicon Valley låser sig for virus
- Hvordan våben giver anledning til masseskyderier i Amerika
- Seneste version af klimasystemmodellen viser bedre ydeevne i simulering
- Ved hjælp af et dybt indlærende neuralt netværk til at give en bil mulighed for at lære at køre…
- Karakteristik af en intertropisk konvergenszone


