Hvorfor er det vanskeligt at bestemme elektronaffiniteter for metaller?
* Metaller har en tendens til at miste elektroner, ikke få dem: Elektronaffinitet er den energiændring, der opstår, når et elektron tilsættes til et neutralt atom i den gasformige tilstand. Metaller har lave ioniseringsenergier, hvilket betyder, at de let mister elektroner for at danne positive ioner (kationer). Dette gør dem mindre tilbøjelige til at få en elektron og danne en negativ ion (anion).
* Tilsætning af et elektron til et metalatom er ofte energisk ugunstigt: Når et metalatom får et elektron, oplever den tilsatte elektron -frastødelse fra de eksisterende elektroner. Denne frastødelse gør processen energisk ugunstig, og derfor er elektronaffinitetsværdien ofte negativ eller meget lille.
* Eksperimentelle vanskeligheder: Måling af elektronaffinitet for metaller er udfordrende. Processen er ofte for kompleks og kræver specialiserede teknikker, der ikke altid er tilgængelige.
I modsætning hertil har ikke -metaller generelt en meget stærkere tendens til at få elektroner. Dette skyldes, at deres elektronkonfigurationer er tæt på en stabil ædelgaskonfiguration, og at tilføje en elektron fylder deres yderste skal. Dette gør processen med elektronforøgelse energisk gunstig, hvilket resulterer i positive og let målbare elektronaffinitetsværdier.
Selvom det er udfordrende at direkte måle elektronaffiniteter for metaller, kan teoretiske beregninger bruges til at estimere disse værdier. Imidlertid har disse beregninger ofte begrænsninger og afspejler muligvis ikke nøjagtigt den eksperimentelle virkelighed.
Sidste artikelHvad er formålet med redoxreaktioner i en celle?
Næste artikelProdukter, der indeholder et element med 26 protoner?
 Varme artikler
Varme artikler
-
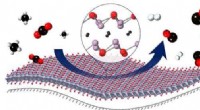 Katalysator for bæredygtig gassynteseEn tynd film af metaloxycarbider på en oxidbærer letter reaktionen mellem CO 2 og methan (CH4) til fremstilling af hydrogen (H2) og kulilte (CO). Kredit:Alexey Kurlov, Evgenia Deeva / ETH Zürich
Katalysator for bæredygtig gassynteseEn tynd film af metaloxycarbider på en oxidbærer letter reaktionen mellem CO 2 og methan (CH4) til fremstilling af hydrogen (H2) og kulilte (CO). Kredit:Alexey Kurlov, Evgenia Deeva / ETH Zürich -
 Sætte fejl på menuen, sikkertKredit:Pixabay/CC0 Public Domain Tanken om at spise insekter er mavedrejning for mange, men ny forskning fra Edith Cowan University (ECU) kaster lys over allergifremkaldende proteiner, som kan udg
Sætte fejl på menuen, sikkertKredit:Pixabay/CC0 Public Domain Tanken om at spise insekter er mavedrejning for mange, men ny forskning fra Edith Cowan University (ECU) kaster lys over allergifremkaldende proteiner, som kan udg -
 Forskere etablerer ny måde at teste for lægemiddelresistente infektionerForskerholdet arbejder nu med klinikere på York Teaching Hospital NHS Foundation Trust for at integrere dette modificerede antibiotikum i en hurtig diagnostisk test for antimikrobiel resistens ved uri
Forskere etablerer ny måde at teste for lægemiddelresistente infektionerForskerholdet arbejder nu med klinikere på York Teaching Hospital NHS Foundation Trust for at integrere dette modificerede antibiotikum i en hurtig diagnostisk test for antimikrobiel resistens ved uri -
 Diamant i nanostørrelse vil forbedre materialer til søtransportNikolai Kakhidze, en kandidatstuderende ved Det Fysiske og Tekniske Fakultet, som netop er vendt tilbage fra praktik på Brunel University Et eksperiment på introduktionen af nanoskala diamant i
Diamant i nanostørrelse vil forbedre materialer til søtransportNikolai Kakhidze, en kandidatstuderende ved Det Fysiske og Tekniske Fakultet, som netop er vendt tilbage fra praktik på Brunel University Et eksperiment på introduktionen af nanoskala diamant i


