Hvis en 2,50-gram prøve af calciummetal opvarmes i en 38.500 gram digel til dannelse af oxid. Hvis og produktet vejer 38.850 g hvilken empirisk formel for oxid?
1. Find massen af ilt
* Massen af digel + calciumoxid =38.850 g
* Massen af digel =38.500 g
* Masse calciumoxid =38,850 g - 38,500 g =0,350 g
* Masse ilt =masse af calciumoxid - masse af calcium =0,350 g - 2,50 g =-2,15 g
2. Konverter masser til mol
* Mol calcium (Ca) =2,50 g / 40,08 g / mol =0,0624 mol
* Mol ilt (O) =-2,15 g / 16,00 g / mol =-0,134 mol
3. Find det enkleste molforhold
* Opdel begge molværdier med den mindre værdi:
* CA:0,0624 mol / 0,0624 mol =1
* O:-0,134 mol / 0,0624 mol =-2,15
4. Rund til det nærmeste forhold mellem hele tal
* Da vi har at gøre med en simpel ionisk forbindelse, skal molforholdet være tæt på hele tal. I dette tilfælde er forholdet mellem CA:O ca. 1:2.
5. Skriv den empiriske formel
* Den empiriske formel for calciumoxidet er Cao₂ .
Vigtig note: Den negative værdi for ilt mol er en fejl i beregningen. Massen af ilt kan ikke være negativ. Der ser ud til at være et problem med de givne oplysninger. Massen af digelen + oxid skal være større end massen af digelen alene.
For at få et mere nøjagtigt svar skal du dobbeltkontroller de givne masser og sørge for, at de er korrekte.
Sidste artikelHvad er formlen for manganacetat?
Næste artikelHvordan ser flydende jernchlorid ud?
 Varme artikler
Varme artikler
-
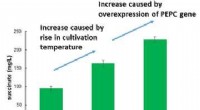 Verdens mest effektive produktion af succinat fra kuldioxidFigur 1:Øgede mængder succinat produceres baseret på overekspression af PEPC -gener og forhøjelse af dyrkningstemperaturen. Kredit:Kobe University Succinat bruges i vid udstrækning som en rå ingre
Verdens mest effektive produktion af succinat fra kuldioxidFigur 1:Øgede mængder succinat produceres baseret på overekspression af PEPC -gener og forhøjelse af dyrkningstemperaturen. Kredit:Kobe University Succinat bruges i vid udstrækning som en rå ingre -
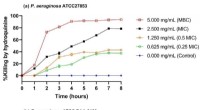 Forbindelse fundet i træer har potentiale til at dræbe lægemiddelresistente bakterierTidsdræbende kurver for (a) lægemiddelfølsom stamme P. aeruginosa ATCC27853 og (b) multilægemiddelresistent stamme P. aeruginosa ATCC BAA-2108 behandlet med og uden indikerede koncentrationer af hydro
Forbindelse fundet i træer har potentiale til at dræbe lægemiddelresistente bakterierTidsdræbende kurver for (a) lægemiddelfølsom stamme P. aeruginosa ATCC27853 og (b) multilægemiddelresistent stamme P. aeruginosa ATCC BAA-2108 behandlet med og uden indikerede koncentrationer af hydro -
 Ingeniører 3-D print højstyrke aluminium, løse ældgamle svejseproblem ved hjælp af nanopartikle…Med denne spændende nye teknik, HRL står i spidsen for et nyt kapitel i additiv fremstilling af metaller til forskning, industri, og forsvar. Kredit:M. Durant HRL Laboratories HRL Laboratories har
Ingeniører 3-D print højstyrke aluminium, løse ældgamle svejseproblem ved hjælp af nanopartikle…Med denne spændende nye teknik, HRL står i spidsen for et nyt kapitel i additiv fremstilling af metaller til forskning, industri, og forsvar. Kredit:M. Durant HRL Laboratories HRL Laboratories har -
 Et skridt tættere på at forstå eksplosiv følsomhed med molekyledesignDaniel Preston (til venstre), Virginia Manner (i midten) og Geoff Brown udarbejder en slagvægtstest på et eksplosivt PETN-derivat. Kredit:Los Alamos National Laboratory Sprængstoffer har et iboend
Et skridt tættere på at forstå eksplosiv følsomhed med molekyledesignDaniel Preston (til venstre), Virginia Manner (i midten) og Geoff Brown udarbejder en slagvægtstest på et eksplosivt PETN-derivat. Kredit:Los Alamos National Laboratory Sprængstoffer har et iboend
- Astronomers simuleringer understøtter teorien om mørkt stof
- Forskere opdager, hvad der gør dybhavsfisketænder gennemsigtige
- Farvel La Nina:Vil tørke, orkaner også gå?
- Atomic jet-den første linse til ekstremt ultraviolet lys udviklet
- Hvorfor er det en god ide at studere eksperimentelle emner på deres naturlige miljø?
- OpenFermion øvelsesværktøj til kvantecomputerkodning


