Hvorfor er vandmolekyler sammenhængende?
* Polaritet: Vandmolekyler er polære, hvilket betyder, at de har en lidt positiv ende (hydrogenatomerne) og en lidt negativ ende (iltatomet). Dette skyldes den ujævne deling af elektroner i molekylet.
* Hydrogenbinding: Den positive ende af et vandmolekyle (brint) tiltrækkes af den negative ende af et andet vandmolekyle (ilt). Denne attraktion kaldes en brintbinding, som er en stærk type intermolekylær kraft.
Konsekvenser af samhørighed:
* Høj overfladespænding: Vandmolekyler på overfladen tiltrækkes stærkt af hinanden, hvilket skaber en høj overfladespænding, der giver insekter mulighed for at gå på vandet.
* Højt kogepunkt: Hydrogenbindingerne holder vandmolekyler sammen, hvilket kræver en betydelig mængde energi for at bryde disse bindinger og omdanne vand til damp.
* kapillær handling: Vandmolekyler tiltrækkes af væggene i smalle rør, hvilket gør det muligt for vand at bevæge sig opad mod tyngdekraften, som det ses i planter.
* opløsningsmiddelegenskaber: Den polære natur af vand giver den mulighed for at opløse mange ioniske og polære forbindelser, hvilket gør det til et fremragende opløsningsmiddel.
Sammenfattende skyldes vandets sammenhængende karakter de stærke brintbindinger mellem dens molekyler. Denne egenskab har betydelige konsekvenser for de fysiske og biologiske egenskaber ved vand.
Sidste artikelHvad er den ædle gasnotation for P?
Næste artikelHvad er opløsningsmidlet og opløstelsen af en mønt?
 Varme artikler
Varme artikler
-
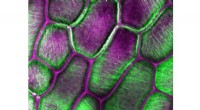 Nye cellulosefund kan føre til nye kemikalier, biobrændstofferForskere afslørede den snoede krystalorientering af cellulosefibre, afbilledet her i grønt i cellerne i en løgskal. Kredit:Edward Wagner, Cosgrove Lab, Penn State En multiinstitutionel forskergrup
Nye cellulosefund kan føre til nye kemikalier, biobrændstofferForskere afslørede den snoede krystalorientering af cellulosefibre, afbilledet her i grønt i cellerne i en løgskal. Kredit:Edward Wagner, Cosgrove Lab, Penn State En multiinstitutionel forskergrup -
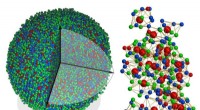 Århundrede gammelt problem løst med første gang nogensinde 3D-atomafbildning af et amorft fast st…Til venstre, en eksperimentel 3D -atommodel af en metallisk glas -nanopartikel, 8 nanometer i diameter. Ret, 3D -atomemballage af et superklynge i strukturen, med forskelligt farvede kugler, der repræ
Århundrede gammelt problem løst med første gang nogensinde 3D-atomafbildning af et amorft fast st…Til venstre, en eksperimentel 3D -atommodel af en metallisk glas -nanopartikel, 8 nanometer i diameter. Ret, 3D -atomemballage af et superklynge i strukturen, med forskelligt farvede kugler, der repræ -
 En 40-årig katalysator afslører sine hemmelighederKredit:CC0 Public Domain Titanium silicalite-1 (TS-1) er ikke en ny katalysator:Det er næsten 40 år siden udviklingen og opdagelsen af dets evne til at omdanne propylen til propylenoxid, et vigt
En 40-årig katalysator afslører sine hemmelighederKredit:CC0 Public Domain Titanium silicalite-1 (TS-1) er ikke en ny katalysator:Det er næsten 40 år siden udviklingen og opdagelsen af dets evne til at omdanne propylen til propylenoxid, et vigt -
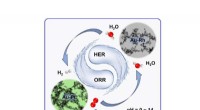 Kemikere udvikler ædelmetal -aerogeler til elektrokemisk brintproduktionNy ædelmetal-aerogeler blev udviklet til fremragende pH-universel elektrokatalyse mod hydrogenudviklingsreaktion og iltreduktionsreaktion. Kredit:Wiley-VCH Elektrocatalyse er et af de mest studere
Kemikere udvikler ædelmetal -aerogeler til elektrokemisk brintproduktionNy ædelmetal-aerogeler blev udviklet til fremragende pH-universel elektrokatalyse mod hydrogenudviklingsreaktion og iltreduktionsreaktion. Kredit:Wiley-VCH Elektrocatalyse er et af de mest studere


