Hvorfor kan nitrogen og ilt danne flere forskellige forbindelser?
* Variabel valens: Både nitrogen og ilt kan udvise flere oxidationstilstande (valenser). Nitrogen kan have valenser på -3, -2, -1, +1, +2, +3, +4 og +5, mens ilt typisk har valenser på -2 og -1. Dette giver mulighed for en lang række mulige kombinationer.
* Flere bindingsmuligheder: Nitrogen og ilt kan danne enkelt-, dobbelt- og tredobbeltbindinger med hinanden. Dette tilføjer yderligere kompleksitet til de typer forbindelser, der kan dannes.
* Forskellige molekylære geometrier: Atomerne i disse molekyler kan arrangere sig i forskellige geometriske konfigurationer (f.eks. Lineære, bøjede, trigonale plane, tetrahedrale), hvilket yderligere diversificerer de mulige forbindelser.
* Forskellige antal atomer: Antallet af nitrogen- og iltatomer i en forbindelse kan variere, hvilket fører til en række molekylære formler. For eksempel er der oxider af nitrogen som N2O (nitrogenoxid), NO (nitrogenoxid), NO2 (nitrogendioxid) og N2O4 (dinitrogen tetroxid).
* tilstedeværelse af andre elementer: Foruden nitrogen og ilt kan forbindelser også omfatte andre elementer og yderligere udvide mulighederne. For eksempel indeholder nitrosyre (HNO2) og salpetersyre (HNO3) også brint.
Eksempler på nitrogen-iltforbindelser:
* nitrogenoxider: N2O, NO, NO2, N2O4, N2O5
* salpetersyre: HNO3
* nitrosyre: Hno2
* nitrogendioxid: NO2
* nitrogenoxid: N2O
Kombinationen af disse faktorer fører til en forskelligartet række nitrogen-iltforbindelser med forskellige egenskaber og anvendelser.
Sidste artikelHvad er hårdheden ved Beryllium?
Næste artikelHvad er et videnskabeligt navn på naturgas?
 Varme artikler
Varme artikler
-
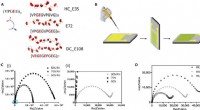 Design af en fritstående, superladet polypeptid-proton-ledende membranDC_E108. Kredit:Science Advances, doi:10.1126/sciadv.abc0810 Protoner er subatomære partikler med en positiv elektrisk ladning. Proton -translokation spiller en væsentlig rolle i naturfænomener og
Design af en fritstående, superladet polypeptid-proton-ledende membranDC_E108. Kredit:Science Advances, doi:10.1126/sciadv.abc0810 Protoner er subatomære partikler med en positiv elektrisk ladning. Proton -translokation spiller en væsentlig rolle i naturfænomener og -
 Nyt værktøj til at forudsige polymeregenskaberKredit:Gent Universitet Et tværfagligt team af forskere har udviklet et kraftfuldt matematisk modelleringsværktøj, der vil give forskere mulighed for at forudsige egenskaberne af polymernetværk, f
Nyt værktøj til at forudsige polymeregenskaberKredit:Gent Universitet Et tværfagligt team af forskere har udviklet et kraftfuldt matematisk modelleringsværktøj, der vil give forskere mulighed for at forudsige egenskaberne af polymernetværk, f -
 En ny form for cellulær logistikMin proteiner interagerer for at danne bølgemønstre (rød) og kan også transportere andre molekyler (blå) ved hjælp af diffusioforese. Kredit:Ramm et. al., Naturfysik 2021 Biofysikere fra Ludwig-Ma
En ny form for cellulær logistikMin proteiner interagerer for at danne bølgemønstre (rød) og kan også transportere andre molekyler (blå) ved hjælp af diffusioforese. Kredit:Ramm et. al., Naturfysik 2021 Biofysikere fra Ludwig-Ma -
 Udskrivning flader polymerer, forbedring af elektriske og optiske egenskaberProfessor Ying Diao, venstre, postdoc forsker Kyung Sun Park, siddende, og kandidatstuderende Justin Kwok har fundet ud af, at snoede polymerer kan flades ud via printprocessen for at gøre dem bedre t
Udskrivning flader polymerer, forbedring af elektriske og optiske egenskaberProfessor Ying Diao, venstre, postdoc forsker Kyung Sun Park, siddende, og kandidatstuderende Justin Kwok har fundet ud af, at snoede polymerer kan flades ud via printprocessen for at gøre dem bedre t
- Undersøgelse giver indsigt i, hvordan celler vender deres beslutning om at dele sig
- Forskere efterligner først naturens vitale kaliumionkanal
- Hvor mange gener invoves i højden o menneske?
- Kranietårn og kraniestativ viser tegn på aztekernes menneskelige ofre i det tidlige Mexico City
- Et stort beskyttet vandmasse?
- Professor i musik optrævler århundreder gammelt forfatterskabsmysterium


