Hvordan er temperatur relateret til bevægelserne af molokuler?
* kinetisk energi: Molekyler er konstant i bevægelse, vibrerer, roterer og oversætter (bevæger sig fra sted til sted). Denne bevægelse er forbundet med energi kaldet kinetisk energi.
* gennemsnitlig kinetisk energi: Mens individuelle molekyler har forskellige kinetiske energier, måler temperaturen den gennemsnitlige kinetiske energi for alle molekyler i et system.
* Højere temperatur =mere bevægelse: Jo højere temperatur, jo hurtigere er molekylernes gennemsnitlige hastighed og jo større er deres kinetiske energi. Dette betyder, at de bevæger sig, vibrerer og roterer mere kraftigt.
* lavere temperatur =mindre bevægelse: Jo lavere temperatur, jo langsommere er molekylernes gennemsnitlige hastighed og jo lavere deres kinetiske energi. De bevæger sig, vibrerer og roterer langsommere.
Eksempler:
* Vand: Når du opvarmer vand, bevæger molekylerne sig hurtigere. Denne øgede bevægelse gør det muligt for vandet at skifte fra en fast (is) til en væske (vand) og til sidst til en gas (damp).
* gas: Gasmolekyler bevæger sig frit og kolliderer med hinanden og væggene i deres beholder. Jo højere temperatur, jo hyppigere og kraftfulde er disse kollisioner, hvilket fører til øget tryk.
Nøglepunkter:
* Temperatur er en makroskopisk egenskab (kan måles), mens kinetisk energi er en mikroskopisk egenskab (vedrører bevægelsen af individuelle molekyler).
* Temperatur er et mål for den gennemsnitlige kinetiske energi, ikke den samlede kinetiske energi.
* Forholdet mellem temperatur og molekylær bevægelse er grundlæggende for at forstå mange fysiske og kemiske fænomener, herunder varmeoverførsel, faseændringer og kemiske reaktioner.
Sidste artikelHvorfor flydende CO2 fordampning og konverteres til tøris?
Næste artikelHvad er eksemplerne på diffusion i væsker hus?
 Varme artikler
Varme artikler
-
 Den banebrydende kunstige fotosyntese kommer tættere påKredit:Pixabay/CC0 Public Domain Forestil dig, at vi kunne gøre, hvad grønne planter kan:fotosyntese. Så kunne vi få dækket vores enorme energibehov med dybgrøn brint og klimaneutral biodiesel. For
Den banebrydende kunstige fotosyntese kommer tættere påKredit:Pixabay/CC0 Public Domain Forestil dig, at vi kunne gøre, hvad grønne planter kan:fotosyntese. Så kunne vi få dækket vores enorme energibehov med dybgrøn brint og klimaneutral biodiesel. For -
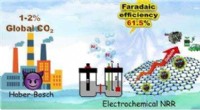 Fremskridt i den billige elektrokemiske syntese af ammoniakVed at efterligne nogle af egenskaberne ved nitrogenase, forskere udviklede en elektrokatalysator, der er i stand til at producere ammoniak fra atmosfærisk nitrogen. Dette kunne hjælpe os med at styre
Fremskridt i den billige elektrokemiske syntese af ammoniakVed at efterligne nogle af egenskaberne ved nitrogenase, forskere udviklede en elektrokatalysator, der er i stand til at producere ammoniak fra atmosfærisk nitrogen. Dette kunne hjælpe os med at styre -
 En bedre HIV-testCheng-ting Jason Tsai, en kandidatstuderende i laboratoriet hos Carolyn Bertozzi, og Peter Robinson, en tidligere kandidatstuderende hos Bertozzi, i 2016, arbejde på en tidligere version af deres test
En bedre HIV-testCheng-ting Jason Tsai, en kandidatstuderende i laboratoriet hos Carolyn Bertozzi, og Peter Robinson, en tidligere kandidatstuderende hos Bertozzi, i 2016, arbejde på en tidligere version af deres test -
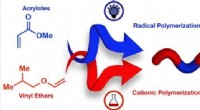 Designer polymerer efter behovKredit:American Chemical Society Når juvelerer laver en halskæde, de styrer rækkefølgen og antallet af hver perle eller juvel, de bruger til at danne et ønsket mønster. Det har været udfordrende f
Designer polymerer efter behovKredit:American Chemical Society Når juvelerer laver en halskæde, de styrer rækkefølgen og antallet af hver perle eller juvel, de bruger til at danne et ønsket mønster. Det har været udfordrende f
- Er latin det sprog, der er mest brugt i videnskab?
- Hvilken slags grænse adskiller den sydamerikanske plade fra Nazca -pladen?
- Nanopartikler bruges til at bryde slimbarrieren i lungerne
- Forbedring af organiske solcellers effektivitet gennem molekylær konstruktion
- Har forskere brug for embryoner for at fremme stamcelleforskningen?
- Harley-Davidson gør oprør med en elektrisk motorcykel (opdatering)


