Danner kobber en kovalent forbindelse?
* Metallisk natur: Kobber er et metal, og metaller har en tendens til at miste elektroner til dannelse af positivt ladede ioner (kationer).
* Elektronegativitet: Kobber har en relativt lav elektronegativitet, hvilket betyder, at det ikke stærkt tiltrækker elektroner.
* binding med ikke -metaller: Kobber danner normalt bindinger med ikke -metaller, som har højere elektronegativitet. Den signifikante forskel i elektronegativitet mellem kobber og ikke -metaller fører til overførsel af elektroner, hvilket resulterer i ioniske bindinger.
Eksempel:
* Kobber (Cu) reagerer med ilt (O) for at danne kobberoxid (CUO). I denne forbindelse mister kobber elektroner til dannelse af cu²⁺ -ioner, og ilt får elektroner til dannelse af o²⁻ioner. Disse modsatte ladede ioner holdes sammen af elektrostatiske kræfter og danner en ionisk binding.
Undtagelser:
Mens kobber overvejende danner ioniske forbindelser, er der et par undtagelser, hvor det kan deltage i kovalent binding:
* Organocopper -forbindelser: Disse forbindelser involverer kobber bundet direkte til carbonatomer, ofte med organiske ligander.
* kobberhalogenider: Kobber kan danne kovalente bindinger med halogener (fluor, klor, brom, iod) til en vis grad.
Kortfattet: Kobber danner primært ioniske forbindelser på grund af dens metalliske natur og elektronegativitet. Imidlertid kan det deltage i kovalent binding i specifikke situationer, især i organocopperforbindelser og i mindre grad med halogener.
Sidste artikelHvor mange mol er i 10000000 molekyler H202?
Næste artikelHvad er metalens karakter?
 Varme artikler
Varme artikler
-
 Miniproteiner, der kan lancere tostrengede angreb på virale proteinerDimerisering af spidsprotein med to-sidet peptid. Kredit:Bhavesh Khatri Den hurtige fremkomst af nye stammer af SARS-CoV-2-viruset har formindsket beskyttelsen fra COVID-19-vacciner. En ny tilgang
Miniproteiner, der kan lancere tostrengede angreb på virale proteinerDimerisering af spidsprotein med to-sidet peptid. Kredit:Bhavesh Khatri Den hurtige fremkomst af nye stammer af SARS-CoV-2-viruset har formindsket beskyttelsen fra COVID-19-vacciner. En ny tilgang -
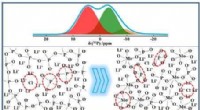 Forskere undersøger strukturen af fosfat-ionisk ledende glas ved hjælp af solid-state NMRStrukturudviklingen af hurtige ionledende glas karakteriseret ved brug af solid-state NMR-teknologier. Kredit:SIOM Glasagtige hurtige ioniske ledere kan bruges som faste elektrolytter, katode ma
Forskere undersøger strukturen af fosfat-ionisk ledende glas ved hjælp af solid-state NMRStrukturudviklingen af hurtige ionledende glas karakteriseret ved brug af solid-state NMR-teknologier. Kredit:SIOM Glasagtige hurtige ioniske ledere kan bruges som faste elektrolytter, katode ma -
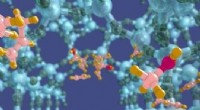 Forskere designer en superkatalysator til at producere plastik og brændstoffer uden råolieKredit:Gent Universitet Forskere fra Gent Universitet brugte computersimuleringer til at opdage et nyt materiale, der effektivt producerer kemiske byggesten til brændstof og plast uden at bruge rå
Forskere designer en superkatalysator til at producere plastik og brændstoffer uden råolieKredit:Gent Universitet Forskere fra Gent Universitet brugte computersimuleringer til at opdage et nyt materiale, der effektivt producerer kemiske byggesten til brændstof og plast uden at bruge rå -
 XenonPy.MDL:Et omfattende bibliotek af fortrænede modeller til materialeegenskaberTermofysiske egenskaber (dvs. termisk ledningsevne) af polymerer forudsagt af transfer learning (TL). Den fælles forskergruppe lykkedes med at konstruere en maskinlæringsmodel, der er i stand til ekst
XenonPy.MDL:Et omfattende bibliotek af fortrænede modeller til materialeegenskaberTermofysiske egenskaber (dvs. termisk ledningsevne) af polymerer forudsagt af transfer learning (TL). Den fælles forskergruppe lykkedes med at konstruere en maskinlæringsmodel, der er i stand til ekst


