Påvirker lufttrykket opløsning af krystaller?
* Opløsning er primært et overfladefænomen: Processen med opløsning involverer interaktionen af krystaloverfladen med opløsningsmiddeltemolekylerne. Luftens bulktryk påvirker ikke direkte denne interaktion.
* opløselighed styres af andre faktorer: Opløseligheden af en krystal i et opløsningsmiddel bestemmes primært af:
* Temperatur: Øget temperatur øger generelt opløselighed.
* arten af opløst stof og opløsningsmiddel: De kemiske egenskaber ved opløst stof og opløsningsmiddel bestemmer, hvor godt de interagerer.
* Koncentration: Mængden af opløst opløst stof, der allerede er til stede, påvirker hastigheden for yderligere opløsning.
Undtagelser og overvejelser:
* meget højt tryk: Under ekstremt høje tryk (ikke typiske forhold) kan der være nogle mindre effekter på opløselighed på grund af ændringer i opløsningsmidlets densitet og egenskaber. Dette er mere relevant inden for specialiserede felter som geokemi.
* Gasser i væsker: Hvis du opløser en gas i et væske, vil lufttrykket have en betydelig indflydelse, da mængden af gas, der er opløst, vil være direkte proportional med det delvise tryk på gassen over væsken.
Kortfattet: For de fleste daglige opløsningssituationer er lufttrykket ikke en vigtig faktor. De andre faktorer, der er anført ovenfor, er langt vigtigere for at bestemme, hvor hurtigt og hvor meget af en krystal opløses.
Sidste artikelHvad er resultatet med jern II -klorid i testflamme?
Næste artikelHvad er hun i kemi står for?
 Varme artikler
Varme artikler
-
 Brug af skovens naturlige evne til at bøje sig ved tørring for at skabe buede strukturerUrbach-tårnet, en 14 m høj bygningsdemonstrator med høj krumning CLT-komponenter fremstillet ved hjælp af selvformende fremstillingsteknologi. Kredit:ICD/ITKE Universitetet i Stuttgart Et team af
Brug af skovens naturlige evne til at bøje sig ved tørring for at skabe buede strukturerUrbach-tårnet, en 14 m høj bygningsdemonstrator med høj krumning CLT-komponenter fremstillet ved hjælp af selvformende fremstillingsteknologi. Kredit:ICD/ITKE Universitetet i Stuttgart Et team af -
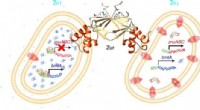 Ny indsigt i, hvordan cyanobakterier regulerer zinkoptagelsen i det åbne havKredit:Claudia Blindauer et al. Marine cyanobakterier (blågrønne alger) er væsentlige bidragsydere til det globale kulstofkredsløb og er grundlaget for fødenettet i mange af verdenshavene. De kræve
Ny indsigt i, hvordan cyanobakterier regulerer zinkoptagelsen i det åbne havKredit:Claudia Blindauer et al. Marine cyanobakterier (blågrønne alger) er væsentlige bidragsydere til det globale kulstofkredsløb og er grundlaget for fødenettet i mange af verdenshavene. De kræve -
 Forskere udvikler den kemi, der er nødvendig for at skabe et alkometer til marihuanaLegaliseringen og afkriminaliseringen af marihuana i Californien og andre steder har gjort afsløring af marihuana særlig vigtig, sagde seniorforfatter Neil Garg. Kredit:Jesse Herring UCLA-kemike
Forskere udvikler den kemi, der er nødvendig for at skabe et alkometer til marihuanaLegaliseringen og afkriminaliseringen af marihuana i Californien og andre steder har gjort afsløring af marihuana særlig vigtig, sagde seniorforfatter Neil Garg. Kredit:Jesse Herring UCLA-kemike -
 Forskere laver kraftfuld undervandslim inspireret af havbarn og muslingerModelfly monteret med silkebaseret lim. Kredit:Marco Lo Presti, Tufts University Hvis du nogensinde har prøvet at hugge en musling ud af en havmur eller et fjeder af bunden af en båd, du vil for
Forskere laver kraftfuld undervandslim inspireret af havbarn og muslingerModelfly monteret med silkebaseret lim. Kredit:Marco Lo Presti, Tufts University Hvis du nogensinde har prøvet at hugge en musling ud af en havmur eller et fjeder af bunden af en båd, du vil for
- Vil du gerne ud i stjernekiggeri? En professionel astronom forklarer, hvor man starter
- Ankommer en P -bølge til seismografen først?
- Nanoelektroder registrerer tusindvis af forbundne pattedyrneuroner indefra
- Nedbrydende BPA med synligt lys og en ny hybrid fotokatalysator
- Hvordan ændrer vandløb sig, når de flyder fra bjerge ned til sletter?
- Hvilke lag af sedimentær sten kan findes i fossiler?


