Hvad er teorien, der reagerer molekyler, skal ramme hinanden med tilstrækkelig energi for at danne produkter?
Her er en oversigt over nøglekomponenterne:
* Collision: For at en kemisk reaktion kan forekomme, skal reaktantmolekyler fysisk kollidere med hinanden.
* Energi: De kolliderende molekyler skal have et minimumsmængde kinetisk energi, kendt som Activation Energy (EA). Denne energi er påkrævet for at bryde de eksisterende bindinger i reaktanterne og tillade dannelse af nye obligationer i produkterne.
* orientering: De kolliderende molekyler skal også have den korrekte orientering i forhold til hinanden. Dette betyder, at atomer, der er involveret i bindingsdannelse, skal placeres på en måde, der letter reaktionen.
Sådan fungerer det:
1. Kollision: Reaktantmolekyler bevæger sig tilfældigt og kolliderer med hinanden.
2. Aktiveringsenergi: Kun kollisioner med tilstrækkelig energi (EA) vil få succes med at bryde obligationer og danne nye.
3. orientering: Selv med nok energi skal de kolliderende molekyler have den korrekte orientering til, at reaktionen kan forekomme.
Faktorer, der påvirker reaktionshastigheden baseret på kollisionsteori:
* Koncentration: Højere koncentrationer fører til flere kollisioner, hvilket øger reaktionshastigheden.
* Temperatur: Højere temperaturer øger den gennemsnitlige kinetiske energi af molekyler, hvilket fører til flere kollisioner med tilstrækkelig energi (EA) og dermed en hurtigere reaktionshastighed.
* overfladeareal: Øget overfladeareal giver flere muligheder for kollisioner, hvilket fremskynder reaktionshastigheden.
* katalysator: Katalysatorer sænker aktiveringsenergien (EA), hvilket gør det lettere for molekyler at reagere og øge reaktionshastigheden.
Kollisionsteorien er et grundlæggende princip i forståelsen af kemisk kinetik, der giver en ramme for at forudsige og kontrollere reaktionshastigheder.
Sidste artikelHvad er det kemiske grundlag for jod og test?
Næste artikelHvad er resultatet med jern II -klorid i testflamme?
 Varme artikler
Varme artikler
-
 En ny måde at teste kropspanser påFørstehjælpere er blandt dem, hvis liv afhænger af rustning - og de ballistiske fibre inde i dem. Kredit:Shutterstock Forskere ved National Institute of Standards and Technology (NIST) har udvikle
En ny måde at teste kropspanser påFørstehjælpere er blandt dem, hvis liv afhænger af rustning - og de ballistiske fibre inde i dem. Kredit:Shutterstock Forskere ved National Institute of Standards and Technology (NIST) har udvikle -
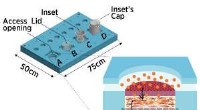 Rekonstruktion af hud på en chipMikrofluid hud-på-en-chip-enhed, der fungerer som et åbent system (A), en bioreaktor med låg (B), og et in vitro analysesystem udstyret med et åbent (C) eller et lukket skær (D). Nærbillede viser en g
Rekonstruktion af hud på en chipMikrofluid hud-på-en-chip-enhed, der fungerer som et åbent system (A), en bioreaktor med låg (B), og et in vitro analysesystem udstyret med et åbent (C) eller et lukket skær (D). Nærbillede viser en g -
 Forskere ser kemisk rækkevidde i mellem-entropi-legeringKredit:CC0 Public Domain Kinesiske forskere har foretaget direkte observationer af ansigtscentrerede kubiske VCoNi (medium) -entropylegeringer (MEA) og for første gang foreslået en overbevisende i
Forskere ser kemisk rækkevidde i mellem-entropi-legeringKredit:CC0 Public Domain Kinesiske forskere har foretaget direkte observationer af ansigtscentrerede kubiske VCoNi (medium) -entropylegeringer (MEA) og for første gang foreslået en overbevisende i -
 Innovative DNA -genopretningsteknikker kan hjælpe ofre med at fange voldtægtsmænd i KenyaEn måde at tackle denne voldelige kriminalitet på er gennem DNA -profilering. Kredit:vitstudio/Shutterstock En kæmpe global sundhedsudfordring er fysisk og seksuel vold mod kvinder og piger, påvir
Innovative DNA -genopretningsteknikker kan hjælpe ofre med at fange voldtægtsmænd i KenyaEn måde at tackle denne voldelige kriminalitet på er gennem DNA -profilering. Kredit:vitstudio/Shutterstock En kæmpe global sundhedsudfordring er fysisk og seksuel vold mod kvinder og piger, påvir
- Var der gammastråler i singulariteten, der gav anledning til Big Bang?
- Mobile enheder reducerer ikke fælles familietid, undersøgelse finder
- Hvad er et vigtigt træk ved alle menneskelige systemer?
- Hvad er oxidationstilstanden for zink i diethylzink?
- Exoplanet opdagelsesværktøj begynder sin mission
- Forskere identificerer den tredje største udbrud i Jordens historie


