Hvorfor danner magnesiumbi -carbonat hydroxid ved kogning?
magnesiumbicarbonat (Mg (HCO3) 2) er ustabil i opløsning og nedbrydes let ved opvarmning.
nedbrydningsreaktionen:
Mg (HCO3) 2 (aq) → Mgco3 (S) + H2O (L) + CO2 (G)
Her er hvad der sker:
* Nedbrydning: Når du opvarmer opløsningen, opdeles magnesiumbicarbonatet i magnesiumcarbonat (MGCO3), vand (H2O) og kuldioxid (CO2).
* Uopløselighed: Magnesiumcarbonat er uopløseligt i vand, så det udfælder ud af opløsningen som et hvidt fast stof.
* kuldioxid Escape: Kuldioxidgasboblerne ud af opløsningen.
I stedet for at danne magnesiumhydroxid (Mg (OH) 2), fører kogning af en magnesiumbicarbonatopløsning til dannelse af magnesiumcarbonat og frigivelse af kuldioxid.
Hvorfor ikke hydroxid?
Magnesiumhydroxid (Mg (OH) 2) er en stærk base, mens magnesiumbicarbonat er en svag base. Ved nedbrydning mister bicarbonationen (HCO3-) en proton (H+) til dannelse af carbonat (CO3^2-) og carbondioxid (CO2). Det resulterende carbonat er ikke grundlæggende nok til at afprotonere vand til at danne hydroxidioner.
I resumé resulterer kogende magnesiumbicarbonat ikke i dannelse af hydroxid, men snarere i nedbrydningen af bicarbonatet til magnesiumcarbonat, vand og kuldioxid.
Sidste artikelHvad er det kemiske navn på MGC2O4?
Næste artikelHvad bærer organiske forbindelser og nogle uorganiske næringsstoffer?
 Varme artikler
Varme artikler
-
 Team udvikler en ny metode til fremstilling af vedvarende acrylonitrilPå billedet fra venstre mod højre ses Adam Bratis, Violeta Sànchez i Nogué, Todd Eaton, Gregg Beckham, Vassili Vorotnikov, og Eric Karp, del af NREL-teamet, der arbejder på en konkurrencedygtig, bæred
Team udvikler en ny metode til fremstilling af vedvarende acrylonitrilPå billedet fra venstre mod højre ses Adam Bratis, Violeta Sànchez i Nogué, Todd Eaton, Gregg Beckham, Vassili Vorotnikov, og Eric Karp, del af NREL-teamet, der arbejder på en konkurrencedygtig, bæred -
 Hvordan nye materialer øger effektiviteten af direkte ethanolbrændselscellerMaterialet består af Nafion med indlejrede nanopartikler. Kredit:B.Matos/IPEN Ethanol har fem gange højere volumetrisk energitæthed (6,7 kWh/L) end brint (1,3 kWh/L) og kan sikkert bruges i brænds
Hvordan nye materialer øger effektiviteten af direkte ethanolbrændselscellerMaterialet består af Nafion med indlejrede nanopartikler. Kredit:B.Matos/IPEN Ethanol har fem gange højere volumetrisk energitæthed (6,7 kWh/L) end brint (1,3 kWh/L) og kan sikkert bruges i brænds -
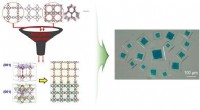 Algoritme identificerer optimale par til at sammensætte metal-organiske rammerFigur:Et eksempel på en rationelt syntetiseret MOF@MOFs (kubisk HKUST-1@MOF-5 ). Kredit:Korea Advanced Institute of Science and Technology (KAIST) Integrationen af metal-organiske rammer (MOFer
Algoritme identificerer optimale par til at sammensætte metal-organiske rammerFigur:Et eksempel på en rationelt syntetiseret MOF@MOFs (kubisk HKUST-1@MOF-5 ). Kredit:Korea Advanced Institute of Science and Technology (KAIST) Integrationen af metal-organiske rammer (MOFer -
 Hudplaster kunne smertefrit levere vacciner, kræftmedicin på et minutEn ny mikronålspleje leverer medicin til melanomer inden for et minut (linealen er i centimeter). Kredit:Celestine Hong og Yanpu He Melanom er en dødelig form for hudkræft, der har været stigende
Hudplaster kunne smertefrit levere vacciner, kræftmedicin på et minutEn ny mikronålspleje leverer medicin til melanomer inden for et minut (linealen er i centimeter). Kredit:Celestine Hong og Yanpu He Melanom er en dødelig form for hudkræft, der har været stigende
- En billig organisk dampgenerator til at rense vand
- Hvor vigtig er solenergi for menneskeheden?
- Hvor meget varme absorberes af en 59 g jernpande, når dens temperatur stiger fra 10oC til 25oC?
- Hvor mange grader er 4-8 Celsius i Fahrenheit?
- Sportspartnerskaber med ikke-for-profitorganisationer viser svage resultater, viser undersøgelsen
- Hvordan sammenlignes dine mas på jorden med messe månen?


