En prøve på 50,0 ml på 0,43 m benzoesyre C6H5COOH titreres med 0,50 NaOH Beregn pH ved ækvivalenspunkt Ka er lig med 6,5 10-5?
1. Forstå reaktionen
Benzoesyre (c₆h₅cooh) er en svag syre, og NaOH er en stærk base. Reaktionen ved ækvivalenspunktet danner natriumbenzoat (c₆h₅coona), salt af den svage syre:
C₆h₅cooh (aq) + NaOH (aq) → c₆h₅coona (aq) + h₂o (l)
2. Beregn molen af benzoesyre
* Mol benzoesyre =(volumen i l) × (molaritet)
* Mol benzoesyre =(0,050 l) × (0,43 mol/l) =0,0215 mol
3. Bestem molen af NaOH ved ækvivalens
På ækvivalenspunktet vil molen af NaOH være lig med molen af benzoinsyre:
* Mol NaOH =0,0215 mol
4. Beregn mængden af NAOH anvendt
* Volumen NaOH =(mol NaOH) / (Molarity of NaOH)
* Volumen NaOH =(0,0215 mol) / (0,50 mol / L) =0,043 L =43,0 ml
5. Bestem koncentrationen af natriumbenzoatet
* Det samlede volumen ved ækvivalenspunktet er 50,0 ml (benzoinsyre) + 43,0 ml (NaOH) =93,0 ml
* Koncentration af natriumbenzoat =(mol natriumbenzoat) / (samlet volumen i L)
* Koncentration af natriumbenzoat =(0,0215 mol) / (0,093 l) =0,231 mol / l
6. Beregn pH i natrium benzoatopløsningen
Natriumbenzoat er salt af en svag syre (benzoesyre) og en stærk base (NaOH). Det vil gennemgå hydrolyse og producere hydroxidioner (OH⁻):
C₆H₅COO⁻ (aq) + H₂O (L) ⇌ C₆H₅COOH (aq) + OH⁻ (aq)
Vi kan bruge følgende trin til at beregne pH:
* Beregn KB:
* KB =KW / KA (hvor KW =1,0 × 10⁻¹⁴)
* Kb =(1,0 × 10⁻¹⁴) / (6,5 × 10⁻⁵) =1,54 × 10⁻¹⁰
* Opret en isbord:
| | C₆h₅coo⁻ | H₂O | C₆h₅cooh | Oh⁻ |
| ----- | ----------- | ------- | ----------- | ------- |
| I | 0,231 | | 0 | 0 |
| C | -x | | +x | +x |
| E | 0,231-x | | X | X |
* Brug KB -udtrykket:
* Kb =[c₆h₅cooh] [oh⁻] / [c₆h₅coo⁻]
* 1,54 × 10⁻¹⁰ =(x) (x) / (0,231 - x)
* Da KB er meget lille, kan vi tilnærme os (0,231 - x) ≈ 0,231
* 1,54 × 10⁻¹⁰ =x² / 0,231
* x² =3,55 × 10⁻¹¹ kort
* x =[oh⁻] =5,96 × 10⁻⁶ m
* Beregn POH:
* poh =-log [oh⁻] =-log (5,96 × 10⁻⁶) =5,23
* Beregn pH:
* pH + POH =14
* pH =14 - 5,23 = 8,77
Derfor er pH ved ækvivalenspunktet for titreringen ca. 8,77.
Sidste artikelHvilke gasser er der i Airasoles?
Næste artikelHvilken naturlig ressource er metal lavet af?
 Varme artikler
Varme artikler
-
 Sensoren registrerer lugt af dårlig åndeKredit:American Chemical Society Har du nogensinde ønsket, at du kunne lave et hurtigt åndedrætstjek før et vigtigt møde eller en stor date? Nu forskere, rapportering i ACS journal Analytisk kemi
Sensoren registrerer lugt af dårlig åndeKredit:American Chemical Society Har du nogensinde ønsket, at du kunne lave et hurtigt åndedrætstjek før et vigtigt møde eller en stor date? Nu forskere, rapportering i ACS journal Analytisk kemi -
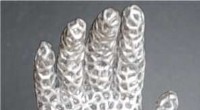 Forskning i flydende metal påberåber Terminator -film - men meget venligereEn hånd, der langsomt åbner sig, når metalgitteret smelter. Kredit:Pu Zhang Pu Zhang kan lide at sammenligne sit teams forskning om flydende metaller med Terminator - specifikt 1991s Terminator 2:
Forskning i flydende metal påberåber Terminator -film - men meget venligereEn hånd, der langsomt åbner sig, når metalgitteret smelter. Kredit:Pu Zhang Pu Zhang kan lide at sammenligne sit teams forskning om flydende metaller med Terminator - specifikt 1991s Terminator 2: -
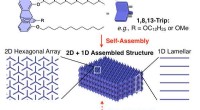 Selvsamlende silikonebaserede polymererFigur 1. Selvsamlende 2D+1D polymerstrukturer. Kredit:©Fumitaka Ishiwari Forskere ved Tokyo Institute of Technology, RIKEN og Tohoku University har udviklet en silikonepolymerkæde, der kan samles
Selvsamlende silikonebaserede polymererFigur 1. Selvsamlende 2D+1D polymerstrukturer. Kredit:©Fumitaka Ishiwari Forskere ved Tokyo Institute of Technology, RIKEN og Tohoku University har udviklet en silikonepolymerkæde, der kan samles -
 Nye kompositmaterialer forlænger levetiden på reservedele til udstyr og køretøjerTest af de nye hybridpulvermaterialer baseret på naturlige lagdelte silikater. Kredit:Roman Savin, FEFU Undersøgelser har vist, at hybridpulvermaterialer baseret på naturlige lagdelte silikater ud
Nye kompositmaterialer forlænger levetiden på reservedele til udstyr og køretøjerTest af de nye hybridpulvermaterialer baseret på naturlige lagdelte silikater. Kredit:Roman Savin, FEFU Undersøgelser har vist, at hybridpulvermaterialer baseret på naturlige lagdelte silikater ud
- Hvad er det bedste materiale, der opsuger et vand?
- Hvad yder ikke støtte til ideen om, at Pluto er et kuiper-bælte objekt?
- 05. Hvilke to parametre afhænger lysstyrken af en stjerne af?
- Hvad vil virkningen af to kræfter lige størrelse, der virker på en bevægelig stiv krop fra mod…
- Hvor stor var La Nina?
- Forskere udforsker, hvordan oversvømmelser og tørker udfordrer videnskaben og samfundet globalt


