Hvordan opfører molekylerne af en gas sig?
1. Konstant tilfældig bevægelse: Gasmolekyler er i konstant, tilfældig bevægelse. Dette betyder, at de bevæger sig i alle retninger og i forskellige hastigheder, kolliderer med hinanden og væggene i deres beholder.
2. Ubetydelige intermolekylære kræfter: I modsætning til væsker og faste stoffer har gasmolekyler meget svage attraktive kræfter mellem dem. Dette skyldes, at de er langt fra hinanden og bevæger sig hurtigt, så deres interaktioner er korte og svage.
3. Høj kompressibilitet: Gasser er meget komprimerbare, hvilket betyder, at deres volumen kan reduceres markant ved at anvende tryk. Dette skyldes, at molekylerne er bredt fordelt, hvilket efterlader en masse tomme mellemrum mellem dem.
4. Udvidelse til at fylde deres container: Gasser udvides til at fylde hele volumenet på deres beholder. Dette skyldes, at molekylerne har nok energi til at overvinde deres svage intermolekylære kræfter og sprede sig.
5. Diffusion og effusion: Gasser udviser diffusion, hvilket betyder, at de kan blande sig med andre gasser. De gennemgår også effusion, som er processen med en gas, der slipper ud gennem et lille hul i et vakuum. Effusionshastigheden er omvendt proportional med kvadratroden af gassens molære masse (Grahams lov).
6. Lav tæthed: Gasser har en lav densitet sammenlignet med væsker og faste stoffer, fordi deres molekyler er spredt, hvilket fører til mindre masse pr. Enhedsvolumen.
7. Kinetisk energi: Gasmolekyler har kinetisk energi på grund af deres konstante bevægelse. Den gennemsnitlige kinetiske energi af molekylerne er direkte proportional med den absolutte temperatur på gassen.
8. Tryk: Det tryk, der udøves af en gas, er et resultat af kollisioner af gasmolekyler med væggene i deres beholder. Trykket øges med stigende temperatur og densitet.
9. Ideel gasadfærd: Mens reelle gasser afviger fra ideel opførsel, især ved høje tryk og lave temperaturer, giver den ideelle gaslov en god tilnærmelse til opførsel af mange gasser under normale forhold. Den ideelle gaslov siger, at PV =NRT, hvor P er tryk, V er volumen, N er antallet af mol, R er den ideelle gaskonstant, og T er temperatur.
At forstå disse egenskaber er afgørende for at forstå gassens opførsel i forskellige anvendelser, herunder atmosfærisk videnskab, kemiske reaktioner og teknik.
 Varme artikler
Varme artikler
-
 Er antivitaminer det nye antibiotika?Kredit:CC0 Public Domain Antibiotika er blandt de vigtigste opdagelser af moderne medicin og har reddet millioner af liv siden opdagelsen af penicillin for næsten 100 år siden. Mange sygdomme fo
Er antivitaminer det nye antibiotika?Kredit:CC0 Public Domain Antibiotika er blandt de vigtigste opdagelser af moderne medicin og har reddet millioner af liv siden opdagelsen af penicillin for næsten 100 år siden. Mange sygdomme fo -
 Høj effektivitet, billig katalysator til vandelektrolyseOxygenudvikling på overfladen af kerne-skal Co@NC elektrode i alkalisk vandelektrolyse. Kredit:Daegu Gyeongbuk Institut for Videnskab og Teknologi (DGIST) Et forskerhold ledet af professor Sanga
Høj effektivitet, billig katalysator til vandelektrolyseOxygenudvikling på overfladen af kerne-skal Co@NC elektrode i alkalisk vandelektrolyse. Kredit:Daegu Gyeongbuk Institut for Videnskab og Teknologi (DGIST) Et forskerhold ledet af professor Sanga -
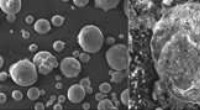 En hårdere ledende keramik til lavere omkostningerScanningselektronmikrofotografier, der viser (venstre mod højre) de rå Ti-partikler, de fladtrykte Ti-partikler efter formaling, og det endelige sintrede Al 2 O 3 -TiN ledende komposit. Kredit:W.
En hårdere ledende keramik til lavere omkostningerScanningselektronmikrofotografier, der viser (venstre mod højre) de rå Ti-partikler, de fladtrykte Ti-partikler efter formaling, og det endelige sintrede Al 2 O 3 -TiN ledende komposit. Kredit:W. -
 Madrester får et dristigt nyt livKredit:University of Tokyo De fleste mennesker tænker ikke meget over de madrester, de smider; imidlertid, forskere fra Institute of Industrial Science ved University of Tokyo har udviklet en ny m
Madrester får et dristigt nyt livKredit:University of Tokyo De fleste mennesker tænker ikke meget over de madrester, de smider; imidlertid, forskere fra Institute of Industrial Science ved University of Tokyo har udviklet en ny m
- Hvilken type obligation er CASO4?
- Hvilken effekt har solflekker på planeter?
- FOTOGALLERI:Supermoon sætter show rundt om i verden
- Hvordan ser et energiressourcekoncept kort over ideer ud?
- Hvad sker der med hvidt sukker, når det blandes med iodiseret salt?
- Miljøvenlige vandtætte polymerfilm syntetiseret ved hjælp af ny metode


