Klorgas reagerer med vandigt kaliumiodid til dannelse af fast jod og chlorid.?
reaktionen
Klorgas (CL₂) reagerer med vandigt kaliumiodid (KI) til dannelse af fast jod (I₂) og vandigt kaliumchlorid (KCL).
Ligningen
Den afbalancerede kemiske ligning for denne reaktion er:
Cl₂ (g) + 2ki (aq) → i₂ (s) + 2kcl (aq)
Forklaring
* enkelt forskydning: Denne reaktion er en enkelt forskydningsreaktion, hvor et mere reaktivt element (klor) fortrænger et mindre reaktivt element (jod) fra dets forbindelse.
* reaktivitet: Klor er mere reaktiv end jod, hvilket betyder, at det har en stærkere tendens til at få elektroner. Dette skyldes sin position i den periodiske tabel (halogener).
* redoxreaktion: Dette er også en redoxreaktion (oxidationsreduktionsreaktion).
* Oxidation: Jod i Ki mister elektroner og oxideres til dannelse af I₂.
* reduktion: Klor får elektroner og reduceres til dannelse af chloridioner (CL⁻) i KCL.
observationer
* farveændring: Løsningen drejer fra farveløs til brun, hvilket indikerer dannelsen af jod.
* solid dannelse: Solid jod (i₂) udfælder ud af opløsningen.
Yderligere noter
* Denne reaktion bruges ofte til at demonstrere de relative reaktiviteter af halogener.
* Reaktionen er eksoterm, hvilket betyder, at den frigiver varme.
Fortæl mig, hvis du gerne vil vide mere om ethvert specifikt aspekt af denne reaktion!
Sidste artikelHvilken hybridisering er til stede i en octahedral molekylær geometri?
Næste artikelHvad er smeltepunktet og kogning af vand?
 Varme artikler
Varme artikler
-
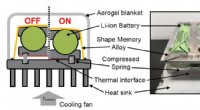 Termiske høreværn beskytter mobiltelefonens batterier mod ekstreme temperaturerDer vises en skematisk og foto af en termisk regulator designet af Berkeley-ingeniører til passivt at holde lithium-ion-batterier inden for et optimalt temperaturområde. Ved højere temperaturer, ledni
Termiske høreværn beskytter mobiltelefonens batterier mod ekstreme temperaturerDer vises en skematisk og foto af en termisk regulator designet af Berkeley-ingeniører til passivt at holde lithium-ion-batterier inden for et optimalt temperaturområde. Ved højere temperaturer, ledni -
 Præcis definerede polymerkæder er nu en realitetDen nye molekyleforbindelsesteknik kan forestilles som tre adskilte jernbanevogne, hver har to unikke koblinger i hver ende, kun tillader dem at blive koblet i en bestemt rækkefølge. Kredit:Takeharu H
Præcis definerede polymerkæder er nu en realitetDen nye molekyleforbindelsesteknik kan forestilles som tre adskilte jernbanevogne, hver har to unikke koblinger i hver ende, kun tillader dem at blive koblet i en bestemt rækkefølge. Kredit:Takeharu H -
 Upcycling af plastikposer til batterideleKredit:American Chemical Society Plastposeforurening er blevet et stort miljøproblem, får nogle byer og lande til at beskatte eller forbyde sækkene kraftigt. Men hvad nu hvis brugte plastikposer k
Upcycling af plastikposer til batterideleKredit:American Chemical Society Plastposeforurening er blevet et stort miljøproblem, får nogle byer og lande til at beskatte eller forbyde sækkene kraftigt. Men hvad nu hvis brugte plastikposer k -
 Samarbejde former ekstracellulær vesikelretentionsstrategiKredit:CC0 Public Domain At udnytte unik ekspertise i samarbejdets ånd er en af Carnegie Mellon Universitys formler for succes. I løbet af de sidste tre år har Phil Campbell og Xi (Charlie) Ren s
Samarbejde former ekstracellulær vesikelretentionsstrategiKredit:CC0 Public Domain At udnytte unik ekspertise i samarbejdets ånd er en af Carnegie Mellon Universitys formler for succes. I løbet af de sidste tre år har Phil Campbell og Xi (Charlie) Ren s
- Hvilket volumen på 0,150 M HCLO4-opløsning er nødvendig for at neutralisere 60 ml 0F 8.6510-2M Na…
- Hvor bæres det eroderede materiale til og af hvad?
- Mikro-spektrometer åbner døren til et væld af nye smartphone-funktioner
- Hvorfor er solcellepaneler sorte i farve?
- Hvordan ændrer tyngdekraften massen?
- Lagdelte grafenplader kunne løse brintlagringsproblemer


