Hvilket volumen på 0,150 M HCLO4-opløsning er nødvendig for at neutralisere 60 ml 0F 8.6510-2M NaOH?
1. Skriv den afbalancerede kemiske ligning:
HCLO₄ (aq) + NaOH (aq) → naclo₄ (aq) + h₂o (l)
2. Bestem molen af NaOH:
* Moles =molaritet * Volumen (i liter)
* Mol NaOH =(8,65 x 10 ² m) * (60 ml / 1000 ml / l) =5,19 x 10⁻³ mol
3. Brug støkiometri til at finde mol HCLO₄:
* Fra den afbalancerede ligning reagerer 1 mol HClo₄₄ med 1 mol NaOH.
* Derfor er mol af HCLO₄ nødvendig =5,19 x 10⁻³ mol
4. Beregn mængden af HCLO₄ -løsning:
* Volumen =mol / molaritet
* Volumen HCLO₄ =(5,19 x 10⁻³ mol) / (0,150 m) =0,0346 L
5. Konverter til milliliter:
* Volumen HCLO₄ =0,0346 L * 1000 ml/L =34,6 ml
Svar: Du har brug for 34,6 ml på 0,150 m HCLO₄ opløsning til neutralisering af 60 ml 8,65 x 10 ² m NaOH -opløsning.
 Varme artikler
Varme artikler
-
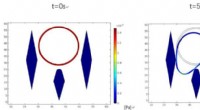 Små filtre hjælper med at opdage kræftblodcellerSimuleringer, der viser cancerøse myelomceller, også kendt som cCPCer, sidde fast mellem mikrosøjler i en ny filterenhed, beskrevet i Biomicrofluidics. Blå kontur er cCPCen, og væsken strømmer fra top
Små filtre hjælper med at opdage kræftblodcellerSimuleringer, der viser cancerøse myelomceller, også kendt som cCPCer, sidde fast mellem mikrosøjler i en ny filterenhed, beskrevet i Biomicrofluidics. Blå kontur er cCPCen, og væsken strømmer fra top -
 Video:Der er endelig (peer reviewed) kemi i vin- og madsammensætningerKredit:The American Chemical Society Rødvin passer til kød; hvidvin passer til fisk. Port går med Stilton. Drik aldrig vin efter at have spist artiskokker. Disse regler om, hvordan man parrer vin m
Video:Der er endelig (peer reviewed) kemi i vin- og madsammensætningerKredit:The American Chemical Society Rødvin passer til kød; hvidvin passer til fisk. Port går med Stilton. Drik aldrig vin efter at have spist artiskokker. Disse regler om, hvordan man parrer vin m -
 Team opdager lysdrevne katalysatorer, der danner olefiner til medicin, landbrugskemisk fremstillingOrganismer, der trives nær varme havåbninger, inspirerede en teknik af forskere fra Rice University, der bruger lys til at udløse et B12 -vitamin, der findes i thermus thermophilus, til at katalysere
Team opdager lysdrevne katalysatorer, der danner olefiner til medicin, landbrugskemisk fremstillingOrganismer, der trives nær varme havåbninger, inspirerede en teknik af forskere fra Rice University, der bruger lys til at udløse et B12 -vitamin, der findes i thermus thermophilus, til at katalysere -
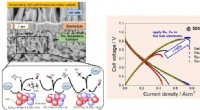 Forskere udvikler højtydende keramisk brændselscelle, der fungerer på butangasNår nikkelkatalysatoren i keramiske brændselsceller bruges sammen med kulbrintebrændstoffer, såsom metan, propan, og butan, det kulstof, der dannes under brændstofomdannelsen, aflejres på overfladen a
Forskere udvikler højtydende keramisk brændselscelle, der fungerer på butangasNår nikkelkatalysatoren i keramiske brændselsceller bruges sammen med kulbrintebrændstoffer, såsom metan, propan, og butan, det kulstof, der dannes under brændstofomdannelsen, aflejres på overfladen a
- Hvad er et sort hul? Søger efter det, der ikke kan ses
- Hvorfor vi bør gøre frikadeller grønne:Ny forskning understreger betydelige miljømæssige fordel…
- Hvad gør den dødbringende pufferfish så liflig
- Diagnosticering af indlæringsvanskeligheder i flersprogede sammenhænge
- Vælg håb eller klimaovergivelse, siger FN -chef
- Hvad er de højeste skyer i himlen lavet af?


