Opløsning af vand og aspirin en syre?
* aspirin (acetylsalicylsyre) er en syre. Det har en carboxylgruppe (-cooh), som kan donere en proton (H+) i opløsning.
* vand er en meget svag syre og en meget svag base. Det kan fungere som både en syre og en base afhængigt af situationen.
* Når aspirin opløses i vand, donerer det nogle af sine protoner til vandmolekyler. Dette skaber hydroniumioner (H3O+), og aspirinmolekylet bliver negativt ladet (aspirinanion).
Så opløsningen af vand og aspirin er sur. De tilstedeværende hydroniumioner får opløsningen til at have en pH -værdi, der er lavere end 7.
Her er en forenklet måde at tænke over det på:
* Aspirin opgiver sine protoner (H+), hvilket gør opløsningen mere sur.
* Vand accepterer nogle af disse protoner, men det ændrer ikke den samlede surhed meget.
Fortæl mig, hvis du gerne vil have flere detaljer om den involverede kemiske reaktion!
 Varme artikler
Varme artikler
-
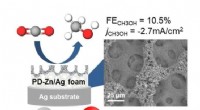 Omdannelse af kuldioxid til methanol(Venstre) Skematisk fremstilling af methanol ved elektrokatalytisk reduktion af kuldioxid ved brug af PD-Zn/Ag skumkatalysatoren. (Højre) Scanning elektronmikroskopi billede af overfladen af PD-Zn/A
Omdannelse af kuldioxid til methanol(Venstre) Skematisk fremstilling af methanol ved elektrokatalytisk reduktion af kuldioxid ved brug af PD-Zn/Ag skumkatalysatoren. (Højre) Scanning elektronmikroskopi billede af overfladen af PD-Zn/A -
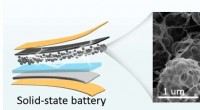 Hierarkisk porøse kulstofnetværk indlejret med enkelte jernsteder til effektiv iltreduktionBilledet til venstre viser den fleksible batterimodel. Et billede af neuronlignende selvbærende fleksibel porøs kulstofstruktur er vist til højre. Kredit:Science China Press I øjeblikket lider oxyg
Hierarkisk porøse kulstofnetværk indlejret med enkelte jernsteder til effektiv iltreduktionBilledet til venstre viser den fleksible batterimodel. Et billede af neuronlignende selvbærende fleksibel porøs kulstofstruktur er vist til højre. Kredit:Science China Press I øjeblikket lider oxyg -
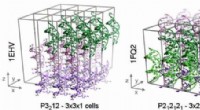 Forskere opnår de første stabile simuleringer af DNA -krystallerDe tre krystal systemer undersøgt i denne undersøgelse. Disse systemer indeholder (fra venstre mod højre) 27, Henholdsvis 24 og 36 dobbeltstrenget DNA. Kredit:Pablo Dans Puiggròs, IRB Barcelona Si
Forskere opnår de første stabile simuleringer af DNA -krystallerDe tre krystal systemer undersøgt i denne undersøgelse. Disse systemer indeholder (fra venstre mod højre) 27, Henholdsvis 24 og 36 dobbeltstrenget DNA. Kredit:Pablo Dans Puiggròs, IRB Barcelona Si -
 Forskere udvikler usynlige anti-forfalskede etiketterKredit:Dmitry Lisovsky for ITMO.NEWS Forskere fra ITMO University og St. Petersburg Academic University udviklede en ny teknologi til mærkning af autentiske varer. Producenter vil være i stand til
Forskere udvikler usynlige anti-forfalskede etiketterKredit:Dmitry Lisovsky for ITMO.NEWS Forskere fra ITMO University og St. Petersburg Academic University udviklede en ny teknologi til mærkning af autentiske varer. Producenter vil være i stand til


