Hvor mange gram saltsyre reageres, når 1,80 mol zink er med 7,10 syre?
1. Skriv den afbalancerede kemiske ligning:
Reaktionen mellem zink (Zn) og saltsyre (HCI) producerer zinkchlorid (ZnCl₂) og brintgas (H₂):
Zn (S) + 2HCI (aq) → Zncl₂ (aq) + H₂ (g)
2. Bestem den begrænsende reaktant:
* mol zink: Du får 1,80 mol zink.
* mol af saltsyre: Du skal konvertere 7,10 g HCL til mol.
* Molmasse HCI =1,01 g/mol (H) + 35,45 g/mol (Cl) =36,46 g/mol
* Mol HCl =(7,10 g) / (36,46 g / mol) =0,195 mol
Den begrænsende reaktant er saltsyre (HCI), fordi du har mindre af det i mol.
3. Beregn massen af HCL -reageret:
* støkiometri: Den afbalancerede ligning fortæller os, at 1 mol Zn reagerer med 2 mol HCI.
* mol HCL -reaktion: Da HCL er den begrænsende reaktant, forbruges den fuldstændigt. Derfor reagerer 0,195 mol HCI.
* masse af HCL:
* Masse HCl =(0,195 mol) * (36,46 g/mol) = 7,10 g
Svar: 7,10 gram saltsyre reageres.
Sidste artikelHvilken væske opløses de fleste elementer i?
Næste artikelKan du give eksempler på forbindelse?
 Varme artikler
Varme artikler
-
 Ferrofluid overfladesimuleringer går mere end huden dybtFerrofluids magnetiske reaktioner kan modelleres til at udvide deres anvendelse inden for en bredere vifte af områder som avanceret elektronik og nanomedicin. Kredit:KAUST Computermodeller simuler
Ferrofluid overfladesimuleringer går mere end huden dybtFerrofluids magnetiske reaktioner kan modelleres til at udvide deres anvendelse inden for en bredere vifte af områder som avanceret elektronik og nanomedicin. Kredit:KAUST Computermodeller simuler -
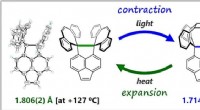 Kulstof-kulstof kovalente bindinger langt mere fleksible end antagetMolekylerne syntetiseret og analyseret af forskergruppen. I grøn og blå er den fleksible C-C enkeltbinding (Takuya Shimajiri, Takanori Suzuki, Yusuke Ishigaki, Angewandte Chemie International Edition,
Kulstof-kulstof kovalente bindinger langt mere fleksible end antagetMolekylerne syntetiseret og analyseret af forskergruppen. I grøn og blå er den fleksible C-C enkeltbinding (Takuya Shimajiri, Takanori Suzuki, Yusuke Ishigaki, Angewandte Chemie International Edition, -
 Video:Sådan slår du krydret pebervarme (tip:mælk er ikke den bedste)Kredit:The American Chemical Society Måske har du hørt, at mælk er den perfekte måde at slukke den krydrede madforbrænding på. Hvorfor er mælk så effektiv? Og hvad hvis du ikke kan drikke mælk? D
Video:Sådan slår du krydret pebervarme (tip:mælk er ikke den bedste)Kredit:The American Chemical Society Måske har du hørt, at mælk er den perfekte måde at slukke den krydrede madforbrænding på. Hvorfor er mælk så effektiv? Og hvad hvis du ikke kan drikke mælk? D -
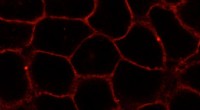 Hvordan forskere analyserer cellemembranerEn ny forbindelse, der efterligner naturligt kolesterol i membraner af levende celler (her:HeLa-celler). Stoffet er mærket med et fluorescerende farvestof (rødt). Kredit:L. Rakers et al./ Cell Chem B
Hvordan forskere analyserer cellemembranerEn ny forbindelse, der efterligner naturligt kolesterol i membraner af levende celler (her:HeLa-celler). Stoffet er mærket med et fluorescerende farvestof (rødt). Kredit:L. Rakers et al./ Cell Chem B
- Hvor mange elementer kan ikke findes i naturen?
- Spotify vs. Apple Music YouTube Music:Hvad er bedst for dine hårdt tjente penge?
- Hvilke planeter i vores solsystem har ingen måner?
- Er solenergi gavnlig for os i fremtiden?
- Hvalfossiler viser vigtige karakterer af overgangen til vand
- Kan der være en tredobbelt regnbue?


