Hvordan opnår en kemisk forbindelse elektrisk neutralitet?
1. Atomer og afgifter:
* Protoner: Beliggende i kernen i et atom, bærer protoner en positiv ladning.
* Elektroner: Elektroner, der kredser om kernen, bærer en negativ ladning.
* neutroner: Også i kernen har neutroner ingen afgift (de er neutrale).
2. Betydningen af valenselektroner:
* Valenselektroner: Dette er de yderste elektroner af et atom, og det er dem, der er involveret i kemisk binding.
* octet regel: Mange atomer stræber efter at have otte valenselektroner (som de ædle gasser, som er meget stabile).
3. Kemisk binding:
* ioniske bindinger: Når et atom får eller mister elektroner for at opnå en stabil elektronkonfiguration, bliver det en ion. En positiv ion (kation) dannes, når et atom mister elektroner. En negativ ion (anion) dannes, når et atom får elektroner.
* kovalente obligationer: Atomer deler elektroner for at opnå en stabil konfiguration.
4. Opnåelse af neutralitet:
* ioniske forbindelser: Når modsat ladede ioner obligerer, annullerer deres anklager hinanden. For eksempel dannes NaCl (tabel salt) fra det positivt ladede natriumion (Na+) og den negativt ladede chloridion (CL-). Den samlede ladning af forbindelsen er nul, hvilket gør den elektrisk neutral.
* kovalente forbindelser: Ved at dele elektroner opnår atomer en stabil konfiguration, hvilket effektivt afbalancerer ladningerne. For eksempel i vand (H2O) deler hvert hydrogenatom et elektron med iltatomet. Denne deling skaber et neutralt molekyle.
Kortfattet:
* Kemiske forbindelser opnår elektrisk neutralitet ved at arrangere deres bestanddele atomer på en måde, der afbalancerer de positive og negative ladninger.
* Denne balance opnås gennem ionisk binding (hvor modsat ladede ioner tiltrækker) eller kovalent binding (hvor elektroner deles).
* Resultatet er en stabil forbindelse med en netneutral ladning.
 Varme artikler
Varme artikler
-
 Tilføjelse af en polymer stabiliserer sammenfaldende metal-organiske rammerPolymer seler, placeret i MOFer med store porer, være med til at hæmme sammenbrud af rammerne. Kredit:Li Peng (EPFL) Metalorganiske rammer (MOFer) er en særlig klasse af svampelignende materialer
Tilføjelse af en polymer stabiliserer sammenfaldende metal-organiske rammerPolymer seler, placeret i MOFer med store porer, være med til at hæmme sammenbrud af rammerne. Kredit:Li Peng (EPFL) Metalorganiske rammer (MOFer) er en særlig klasse af svampelignende materialer -
 Udvidelse af metaltolerance for hydrogelerInspireret af væv, der holder musklerne knyttet til sten under vandet, MIT kandidatstuderende Seth Cazzell (billedet) og lektor Niels Holten-Andersen fandt ud af, at kontrol af pH muliggør reversibel
Udvidelse af metaltolerance for hydrogelerInspireret af væv, der holder musklerne knyttet til sten under vandet, MIT kandidatstuderende Seth Cazzell (billedet) og lektor Niels Holten-Andersen fandt ud af, at kontrol af pH muliggør reversibel -
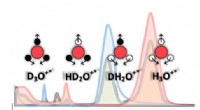 Flydende vand er mere end bare brint-ilt-molekylerInfrarøde lysspektre (rødt), tung (blå), halvtungt (grå) vand, og ioniske arter, der er blevet identificeret i den aktuelle undersøgelse. Rød, hvide og sorte cirkler viser ilt, hydrogen- og deuteriuma
Flydende vand er mere end bare brint-ilt-molekylerInfrarøde lysspektre (rødt), tung (blå), halvtungt (grå) vand, og ioniske arter, der er blevet identificeret i den aktuelle undersøgelse. Rød, hvide og sorte cirkler viser ilt, hydrogen- og deuteriuma -
 Forskere opnår nye resultater på dielektronisk rekombinationspræcisionsspektroskopiFig. 1 DR-spektrum og plasmahastighedskoefficient for carbonlignende Ca 14 + ioner. Kredit:IMP Forskere ved Institute of Modern Physics (IMP) ved det kinesiske videnskabsakademi (CAS) og deres
Forskere opnår nye resultater på dielektronisk rekombinationspræcisionsspektroskopiFig. 1 DR-spektrum og plasmahastighedskoefficient for carbonlignende Ca 14 + ioner. Kredit:IMP Forskere ved Institute of Modern Physics (IMP) ved det kinesiske videnskabsakademi (CAS) og deres


