Hvordan reagerer en ligevægtsreaktion på ekstra reaktantens addiof?
le Chateliers princip
Opførslen af en ligevægtsreaktion, når du tilføjer mere reaktant, forklares af Le Chateliers princip. Det siger:
* Hvis der anvendes en ændring af betingelsen på et system i ligevægt, skifter systemet i en retning, der lindrer stresset.
skiftet
Når du tilføjer mere reaktant til en ligevægtsreaktion, stresses systemet. For at lindre denne stress vil reaktionen skifte til højre , hvilket betyder, at det vil favorisere fremadrettet reaktion .
* fremadrettet reaktion: Reaktionen, der forbruger reaktanterne til at fremstille produkter.
Hvorfor skiftet forekommer
* øget reaktantkoncentration: Tilføjelse af mere reaktant øger sin koncentration.
* øget kollisionshastighed: Højere reaktantkoncentration betyder flere kollisioner mellem reaktantmolekyler.
* øget frekvens af fremadrettet reaktion: Flere kollisioner fører til en hurtigere hastighed af den fremadrettede reaktion ved at forbruge den tilsatte reaktant.
* skift i ligevægt: Systemet skifter til højre for at forbruge den overskydende reaktant og nå en ny ligevægt.
eksempel
Overvej følgende reversible reaktion:
`` `
N2 (g) + 3H2 (g) ⇌ 2NH3 (g)
`` `
Hvis du tilsætter mere nitrogengas (N2), skifter ligevægten til højre og producerer mere ammoniak (NH3) og forbruger noget af det tilsatte nitrogen.
Nøglepunkter
* Ligevægten skifter til højre og favoriserer den fremadgående reaktion.
* Systemet når til sidst en ny ligevægt med en højere koncentration af produkter og en lavere koncentration af den tilsatte reaktant.
* Det nøjagtige skift i ligevægt afhænger af den specifikke reaktion og mængden af tilsat reaktant.
Fortæl mig, hvis du gerne vil have en mere detaljeret forklaring eller have yderligere spørgsmål!
 Varme artikler
Varme artikler
-
 Sensorer registrerer sygdomsmarkører i åndedrættetForskerne lavede sensorer af porøse tynde film af organisk ledende plast med målet om bærbar, engangsudstyr til medicinsk og miljømæssig overvågning. Kredit:L. Brian Stauffer En lille, tynd firkan
Sensorer registrerer sygdomsmarkører i åndedrættetForskerne lavede sensorer af porøse tynde film af organisk ledende plast med målet om bærbar, engangsudstyr til medicinsk og miljømæssig overvågning. Kredit:L. Brian Stauffer En lille, tynd firkan -
 Hvorfor nogle grønne bliver brune i historiske malerierEt maleri, Noli me tangere af Angolo Bronzino (ca. 1560) (A), viser mørkfarvning af grønt kobberpigment i et lyseksponeret område (C), men ikke i et område beskyttet af rammen (B). Kredit:Tilpasset
Hvorfor nogle grønne bliver brune i historiske malerierEt maleri, Noli me tangere af Angolo Bronzino (ca. 1560) (A), viser mørkfarvning af grønt kobberpigment i et lyseksponeret område (C), men ikke i et område beskyttet af rammen (B). Kredit:Tilpasset -
 Slukningspulver genbrugt i gødning og brandhæmmereKredit:ProPHOS Chemicals Et EU-finansieret projekt har genanvendt fosfat fra opbrugt slukningspulver til fremstilling af gødning til landbruget og flammehæmmere til træsektoren. Det italiensk-bas
Slukningspulver genbrugt i gødning og brandhæmmereKredit:ProPHOS Chemicals Et EU-finansieret projekt har genanvendt fosfat fra opbrugt slukningspulver til fremstilling af gødning til landbruget og flammehæmmere til træsektoren. Det italiensk-bas -
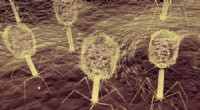 Viruss mangestrengede angreb på bakterier peger på nye måder at bekæmpe infektion påFager angriber en bakterie. Kredit:Imperial College London Forskere har afdækket, hvordan en virus anvender et todelt angreb mod et enkelt protein for at dræbe bakterier. Den internationale grupp
Viruss mangestrengede angreb på bakterier peger på nye måder at bekæmpe infektion påFager angriber en bakterie. Kredit:Imperial College London Forskere har afdækket, hvordan en virus anvender et todelt angreb mod et enkelt protein for at dræbe bakterier. Den internationale grupp
- Afdækning af vores solsystemers form
- Hvad er accelerationen af en 37 kg blok, når den trækkes med kraft 170 n?
- Hvor er alle svalerne blevet af?
- Glas og energireformen:Bæredygtig produktion takket være elektricitet?
- Canada, Holland tester epassport til transatlantiske flyvninger
- Hvad er problemet for sukker og salt i vands frysepunkt?


