Hvad er ligevægtskonstanten for en reaktion?
Her er en sammenbrud:
* reversible reaktioner: Dette er reaktioner, hvor produkterne kan reagere for at danne reaktanterne igen. De fortsætter i både fremadgående og omvendte retninger.
* ligevægt: En tilstand i en reversibel reaktion, hvor hastighederne for de fremadgående og omvendte reaktioner er ens. Koncentrationerne af reaktanter og produkter forbliver konstante.
Sådan beregnes K:
* k =[produkter]/[reaktanter]
* [] Repræsenterer koncentrationen af hver art ved ligevægt (normalt i mol pr. Liter, m).
* Eksponenterne for hver koncentrationsperiode er de støkiometriske koefficienter for den afbalancerede kemiske ligning.
Nøglepunkter om K:
* Større K -værdier indikerer, at reaktionen favoriserer dannelsen af produkter.
* mindre K -værdier indikerer, at reaktionen favoriserer dannelsen af reaktanter.
* k er specifik for en bestemt reaktion ved en bestemt temperatur.
* k kan bruges til at forudsige den retning, en reaktion vil skifte for at nå ligevægt.
Eksempel:
For den reversible reaktion:
aa + bb ⇌ cc + dd
Ligevægtskonstanten er:
k =([c]^c * [d]^d) / ([a]^a * [b]^b)
Forståelse K:
* Hvis k er meget stor (f.eks. 10^6), foretrækkes produkterne stærkt ved ligevægt.
* Hvis k er meget lille (f.eks. 10^-6), foretrækkes reaktanterne stærkt ved ligevægt.
* Hvis K er tæt på 1, er koncentrationerne af reaktanter og produkter omtrent ens med ligevægt.
Sammenfattende er ligevægtskonstanten et værdifuldt værktøj til at forstå opførelsen af reversible reaktioner og forudsige deres resultater under forskellige forhold.
Sidste artikelHvordan reagerer en ligevægtsreaktion på ekstra reaktantens addiof?
Næste artikelHvor stammer kemiske meddelelser fra?
 Varme artikler
Varme artikler
-
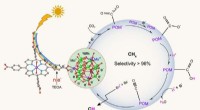 Polyoxometalat-baserede koordinationsrammer for metangenerering i fotoreduktion af kuldioxidPOMCF til konvertering af CO2 til CH4 i fotoreduktionssystem Kredit:©Science China Press Overdreven CO 2 udledning fra vedvarende afbrænding af fossile brændstoffer har forårsaget global opvarmn
Polyoxometalat-baserede koordinationsrammer for metangenerering i fotoreduktion af kuldioxidPOMCF til konvertering af CO2 til CH4 i fotoreduktionssystem Kredit:©Science China Press Overdreven CO 2 udledning fra vedvarende afbrænding af fossile brændstoffer har forårsaget global opvarmn -
 Havpattedyrs tilpasninger til lavt ilt giver et nyt perspektiv på COVID-19Kredit:CC0 Public Domain Da Terrie Williams begyndte at høre om den brede vifte af symptomer, som patienter med COVID-19 oplevede, hun så en sammenhæng mellem de forskellige måder sygdommen påvirk
Havpattedyrs tilpasninger til lavt ilt giver et nyt perspektiv på COVID-19Kredit:CC0 Public Domain Da Terrie Williams begyndte at høre om den brede vifte af symptomer, som patienter med COVID-19 oplevede, hun så en sammenhæng mellem de forskellige måder sygdommen påvirk -
 Svovlindhold i nogle højtydende stoffer svækker dem, når de udsættes for fugtPh.d.-studerende Saiful Hoque ledede ny forskning, der kunne vise vejen til at udvikle stærkere, sikrere beskyttelsestøj til brandmænd og andre arbejdere. Kredit:University of Alberta Forskere har
Svovlindhold i nogle højtydende stoffer svækker dem, når de udsættes for fugtPh.d.-studerende Saiful Hoque ledede ny forskning, der kunne vise vejen til at udvikle stærkere, sikrere beskyttelsestøj til brandmænd og andre arbejdere. Kredit:University of Alberta Forskere har -
 Lerbaseret antimikrobiel emballage holder maden friskKontroltomater (til venstre) rådnede efter seks dage, mens de, der var pakket ind i en ny lerbaseret film (til højre) forblev friske. Kredit:Hayriye Ünal Nogle gange ser det ud som om frisk frugt,
Lerbaseret antimikrobiel emballage holder maden friskKontroltomater (til venstre) rådnede efter seks dage, mens de, der var pakket ind i en ny lerbaseret film (til højre) forblev friske. Kredit:Hayriye Ünal Nogle gange ser det ud som om frisk frugt,
- Hvilke kemikalier får en glød til at holde længere?
- Den mest almindelige form for glimmer, der er nøjagtigt i forskellige klipper, herunder Gneiss Gran…
- Forkert sving og bakker har øjne?
- Findes petroleum i forskellige farver?
- Virtual reality bringer hundenes anatomi til live for veterinærstuderende
- Hvad er regionen, der spænder fra Valley of Mexico til Costa Rica i Mellemamerika?


