Hvad er ændringen i energi ΔE kilojoules pr. Mol brintatomer til en elektronovergang fra N6 til N2?
1. Rydberg -formlen
Rydberg -formlen beregner energiændringen for elektroniske overgange i brint:
`` `
1/λ =r (1/n₁² - 1/n₂²)
`` `
Hvor:
* λ er bølgelængden af det udsendte eller absorberede lys
* r er Rydberg -konstanten (1.097 x 10 ⁻¹)
* n₁ er det oprindelige energiniveau (lavere energiniveau)
* n₂ er det endelige energiniveau (højere energiniveau)
2. Beregn bølgelængden (λ)
* n₁ =2 (oprindeligt niveau)
* n₂ =6 (slutniveau)
Sæt disse værdier i Rydberg -formlen:
`` `
1/λ =(1.097 x 10⁷ M⁻¹) (1/2² - 1/6²)
1/λ =2,438 x 10⁶ M⁻¹
λ =4,10 x 10⁻⁷ m
`` `
3. Beregn energi (ΔE)
Vi kan bruge følgende forhold til at relatere bølgelængde og energi:
`` `
ΔE =hc/λ
`` `
Hvor:
* h er Plancks konstante (6.626 x 10⁻³⁴ j⋅s)
* C er lysets hastighed (2.998 x 10⁸ m/s)
* λ er bølgelængden (beregnet ovenfor)
Tilslut værdierne:
`` `
ΔE =(6,626 x 10⁻³⁴ J⋅s) (2,998 x 10⁸ m / s) / (4,10 x 10⁻⁷ m)
ΔE =4,84 x 10⁻¹⁹ J
`` `
4. Konverter til KJ/mol
* konverter J til KJ: Del med 1000
* Konverter pr. Atom til pr. Mol: Multiplicer med Avogadros nummer (6.022 x 10²³ atomer/mol)
`` `
ΔE =(4,84 x 10⁻¹⁹ J) * (1 kJ/1000 J) * (6,022 x 10²³ Atomer/mol)
ΔE ≈ 291 kJ/mol
`` `
Derfor er ændringen i energi (ΔE) for elektronovergangen fra n =6 til n =2 i et brintatom ca. 291 kJ/mol. Dette er en positiv værdi, der indikerer, at energi absorberes under denne overgang.
Sidste artikelKan beskrive de partikler, der udgør hvert af luftvand og metal?
Næste artikelFlytter molekyler i bevægelsesløse væsker?
 Varme artikler
Varme artikler
-
 Forskere kombinerer levende og livløse stofferOleg Bolshakov. Kredit:SUSU Moderne kosmetik og medicinske implantater indeholder mange uorganiske stoffer. Undersøgelser fra forskere fra South Ural State University har til formål at forstå, hvo
Forskere kombinerer levende og livløse stofferOleg Bolshakov. Kredit:SUSU Moderne kosmetik og medicinske implantater indeholder mange uorganiske stoffer. Undersøgelser fra forskere fra South Ural State University har til formål at forstå, hvo -
 Hurtig test finder tegn på sepsis i en enkelt dråbe blodUniversity of Illinois forskere og læger på Carle Foundation Hospital udviklede en hurtig test for sepsis, der tæller hvide blodlegemer og proteinmarkører på deres overflade for at overvåge en patient
Hurtig test finder tegn på sepsis i en enkelt dråbe blodUniversity of Illinois forskere og læger på Carle Foundation Hospital udviklede en hurtig test for sepsis, der tæller hvide blodlegemer og proteinmarkører på deres overflade for at overvåge en patient -
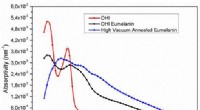 Vil cyborgs blive lavet af melanin? Pigmentgennembrud muliggør biokompatibel elektronikUV-Vis absorptionsevne (procent absorbans/filmtykkelse) af filmene på de forskellige procestrin:(rød, cirkler) DHI; (sort, firkanter) DHI-eumelanin (film efter AISSP); (blå, trekanter) HVAE (film efte
Vil cyborgs blive lavet af melanin? Pigmentgennembrud muliggør biokompatibel elektronikUV-Vis absorptionsevne (procent absorbans/filmtykkelse) af filmene på de forskellige procestrin:(rød, cirkler) DHI; (sort, firkanter) DHI-eumelanin (film efter AISSP); (blå, trekanter) HVAE (film efte -
 Hvad gør vin tør? Den er nem at smage, men meget sværere at måleEn masse kemi og fysik ligger bag, hvordan du opfatter en tår vin. Kredit:GANNA MARTYSHEVA/Shutterstock.com Når du tager en tår vin til et familiemåltid eller fest, hvad lægger du mærke til? Førs
Hvad gør vin tør? Den er nem at smage, men meget sværere at måleEn masse kemi og fysik ligger bag, hvordan du opfatter en tår vin. Kredit:GANNA MARTYSHEVA/Shutterstock.com Når du tager en tår vin til et familiemåltid eller fest, hvad lægger du mærke til? Førs
- Hvad er klokken på Mars?
- Nyt lille molekyle hjælper videnskabsmænd med at studere regenerering
- At finde ud af, hvordan man indånder månernes regolith
- Hvilken mikroorganisme går ned af affald?
- Et Tiltmeter er et vulkansk overvågningsværktøj, der måler?
- Fremstilling af xylitol og cellulose nanofibre af papirpasta – mod et grønt og bæredygtigt samfund


