Hvor mange gram dichlormethan er resultatet af reaktion 1,54 kg methan, hvis udbyttet er 48,2?
1. Afbalanceret kemisk ligning:
Først har vi brug for den afbalancerede kemiske ligning til reaktion af metan (CH₄) med klor (CL₂) for at producere dichlormethan (CH₂CL₂):
CH₄ + 2Cl₂ → Ch₂cl₂ + 2HCl
2. Molforhold:
Ligningen fortæller os, at 1 mol metan reagerer for at producere 1 mol dichlormethan.
3. Konverter masse af metan til mol:
* molmasse af metan (CH₄) =12,01 g/mol (C) + 4 * 1,01 g/mol (H) =16,05 g/mol
* Mass af metan =1,54 kg =1540 g
* mol methan =1540 g/16,05 g/mol =95,96 mol
4. Beregn teoretisk udbytte af dichlormethan:
* Da molforholdet er 1:1, er det teoretiske udbytte af dichlormethan også 95,96 mol.
5. Beregn det faktiske udbytte af dichlormethan:
* procent udbytte =(faktisk udbytte / teoretisk udbytte) * 100%
* faktisk udbytte =(procent udbytte / 100%) * Teoretisk udbytte
* Faktisk udbytte =(48,2 / 100) * 95,96 mol =46,26 mol
6. Konverter mol af dichlormethan til gram:
;
* masse af dichlormethan =46,26 mol * 84,93 g/mol =3935 g
Derfor er 3935 gram dichlormethan resultatet af reaktionen på 1,54 kg metan med et udbytte på 48,2%.
Sidste artikelHvilket element er mellem Tellurium og Noble Gas Xenon?
Næste artikelHvad er et atom med to neutroner protoner og elektroner?
 Varme artikler
Varme artikler
-
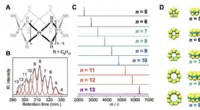 En forberedende reaktion ved hjælp af platinklynger med en encifret atomicitet realiseretFigur (A) viser kompleksernes kemiske struktur, (B) viser kromatogrammet for HPLC -adskillelsen med størrelsesekskluderingskolonner, (C) viser MALDI-TOF-massespektre for de isolerede platinkomplekser
En forberedende reaktion ved hjælp af platinklynger med en encifret atomicitet realiseretFigur (A) viser kompleksernes kemiske struktur, (B) viser kromatogrammet for HPLC -adskillelsen med størrelsesekskluderingskolonner, (C) viser MALDI-TOF-massespektre for de isolerede platinkomplekser -
 Forskere fremmer indsatsen for nøjagtigt at måle glyphosat-pesticid i havrePrøver af havregryn og havrebaserede produkter analyseret for glyphosat og AMPA. Kredit:J. Murray/NIST Pesticider hjælper landmænd med at øge fødevareproduktionen, reducere dyre skader på afgrøder
Forskere fremmer indsatsen for nøjagtigt at måle glyphosat-pesticid i havrePrøver af havregryn og havrebaserede produkter analyseret for glyphosat og AMPA. Kredit:J. Murray/NIST Pesticider hjælper landmænd med at øge fødevareproduktionen, reducere dyre skader på afgrøder -
 Små molekyler kan være nøglen til at øge effektiviteten af organiske solcellerTolags solcelle baseret på den organiske halvleder kobber(I) thiocyanat (CuSCN) giver en ny platform for exciton diffusionsundersøgelser. Kredit:KAUST At forstå, hvordan partikler bevæger sig genn
Små molekyler kan være nøglen til at øge effektiviteten af organiske solcellerTolags solcelle baseret på den organiske halvleder kobber(I) thiocyanat (CuSCN) giver en ny platform for exciton diffusionsundersøgelser. Kredit:KAUST At forstå, hvordan partikler bevæger sig genn -
 Undersøge vand af en elektrificerende årsagKAUST-forskere observerede, at vedhængende dråber dannet fra hydrofobe kapillærer til ensartede elektriske felter. Kredit:KAUST; Anastasia Serin Et eksperiment, elegant i sin enkelhed, hjælper med
Undersøge vand af en elektrificerende årsagKAUST-forskere observerede, at vedhængende dråber dannet fra hydrofobe kapillærer til ensartede elektriske felter. Kredit:KAUST; Anastasia Serin Et eksperiment, elegant i sin enkelhed, hjælper med
- Hvorfor kan Hubble -teleskopet se bedre end en på jorden?
- Forskere fastsætter tidsbegrænsning for ultrahurtige perovskite solceller
- Hvilken type teleskop bruger to linser?
- Vedvarende kul i horisonten
- Taxonomi er den videnskab, der beskæftiger sig med?
- Lava sprøjter fra vulkanen Island for anden dag, da dens sprække strækker sig 2 miles


