Hvorfor opfører ammoniak NH3, så snart en base reagerer den med en syre?
1. Lone par elektroner: Ammoniak har et ensomt par elektroner på nitrogenatomet. Dette ensomme par er let tilgængeligt til at acceptere en proton, hvilket gør ammoniak til en Lewis -base.
2. Dannelse af ammoniumion: Når ammoniak reagerer med en syre, accepterer det ensomme par på nitrogenatomet en proton fra syren og danner ammoniumion (NH4+). Denne reaktion er en ligevægtsreaktion:
NH3+ H+ ⇌ NH4+
3. Brønsted-Lowry Definition: I henhold til Brønsted-Lowry-definitionen af syrer og baser er en base et stof, der accepterer en proton. Ammoniak passer til denne definition, fordi den let accepterer en proton fra en syre, der danner ammoniumion.
Eksempel:
Når ammoniak reagerer med saltsyre (HCI), opstår følgende reaktion:
NH3 + HCL ⇌ NH4 + + CL-
I denne reaktion accepterer ammoniak en proton fra HCI, der danner ammoniumion (NH4+) og chloridion (Cl-). Denne reaktion er et klassisk eksempel på ammoniak, der fungerer som base.
Konklusion:
Ammoniaks evne til at acceptere en proton på grund af dets ensomme par elektroner gør det til en base i henhold til både Lewis og Brønsted-Lowry-definitionerne. Dets reaktion med syrer resulterer i dannelsen af ammoniumionen, et klassisk egenskab ved en base, der reagerer med en syre.
Sidste artikelHvad er det eksplosive interval for naturgas?
Næste artikelHvornår betragtes et atom, der overvejes isotop?
 Varme artikler
Varme artikler
-
 Hvordan syrer opfører sig i det ultrakolde interstellare rumHoldet på Cluster of Excellence Resolv har undersøgt kemi i det interstellare rum. Kredit: RUB, Lehrstuhl for Astrophysik En forskergruppe fra Ruhr-Universität Bochum har undersøgt, hvordan syrer
Hvordan syrer opfører sig i det ultrakolde interstellare rumHoldet på Cluster of Excellence Resolv har undersøgt kemi i det interstellare rum. Kredit: RUB, Lehrstuhl for Astrophysik En forskergruppe fra Ruhr-Universität Bochum har undersøgt, hvordan syrer -
 Kigger inde i glassetKredit:Lynn Greyling/public domain Et team af forskere fra Institute of Industrial Science ved University of Tokyo brugte avanceret elektronspektroskopi og computersimuleringer til bedre at forstå
Kigger inde i glassetKredit:Lynn Greyling/public domain Et team af forskere fra Institute of Industrial Science ved University of Tokyo brugte avanceret elektronspektroskopi og computersimuleringer til bedre at forstå -
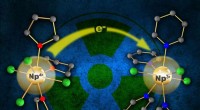 Åbner adgang til at udforske neptuniums syntetiske kemiEn ny, let fremstillet udgangsmateriale (til venstre) indeholdende neptunium (Np3+) kan let fremstilles ved en elektron (e-) overførsel til en moder neptunium (Np4+) forbindelse (højre). Denne proces
Åbner adgang til at udforske neptuniums syntetiske kemiEn ny, let fremstillet udgangsmateriale (til venstre) indeholdende neptunium (Np3+) kan let fremstilles ved en elektron (e-) overførsel til en moder neptunium (Np4+) forbindelse (højre). Denne proces -
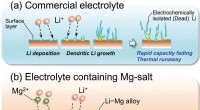 Forskere tager skridt mod sikrere batterier ved at trimme litiumgreneSkematisk illustration af den foreslåede undertrykkende effekt af Li dendritisk vækst ved tilsætning af Mg-salt. Kredit:Royal Society of Chemistry Et samarbejdende team af forskere fra Shinshu Uni
Forskere tager skridt mod sikrere batterier ved at trimme litiumgreneSkematisk illustration af den foreslåede undertrykkende effekt af Li dendritisk vækst ved tilsætning af Mg-salt. Kredit:Royal Society of Chemistry Et samarbejdende team af forskere fra Shinshu Uni
- Forskere finder jernsne i Jordens kerne
- Team udvikler ny guld nanocluster-rig titaniumdioxid fotokatalysator til oxidativ kobling af metan
- Hvilket objekt afgiver sit eget lys?
- Du bruger allerede heuristik hver dag. Her er hvad de er
- COVID-19 har negativt påvirket, hvordan revisorer arbejder
- Angrebshelikoptere er en online-subkultur, du skal passe på


