Hvorfor er elektrolyse af surt vand et eksempel på katalyse?
* katalyse involverer et stof (katalysatoren), der fremskynder en kemisk reaktion uden at blive konsumeret i processen. Katalysatoren sænker den aktiveringsenergi, der kræves for at reaktionen kan forekomme.
* elektrolyse af surt vand involverer nedbrydning af vand til brint og iltgas ved hjælp af elektricitet. Den elektriske strøm giver energien til at drive reaktionen.
Her er sammenbruddet:
1. Aciduleret vand: Tilsætningen af en lille mængde syre (som svovlsyre) til vand øger dens ledningsevne, hvilket gør det lettere for den elektriske strøm at passere.
2. elektrolyse: De elektriske energi bryder vandmolekylerne i brint og iltgas.
3. Ingen katalysator: Syren fungerer ikke som en katalysator. Det forbedrer blot løsningen af løsningen. Den energi, der er nødvendig til reaktionen, tilvejebringes af den elektriske strøm, ikke af nogen katalytisk virkning.
Konklusion: Elektrolysen af surt vand er en kemisk reaktion drevet af en ekstern energikilde (elektricitet), ikke af en katalysator. Syren hjælper kun processen ved at øge opløsningens ledningsevne.
 Varme artikler
Varme artikler
-
 Designerproteiner danner ledninger og gitter på mineraloverfladenForskere har skabt syntetiske proteiner, vist i orange, der danner honeycomb-lignende strukturer på atomoverfladen af glimmer, vist her som solbrune kugler. Kredit:PNNL Målet med forskningen, of
Designerproteiner danner ledninger og gitter på mineraloverfladenForskere har skabt syntetiske proteiner, vist i orange, der danner honeycomb-lignende strukturer på atomoverfladen af glimmer, vist her som solbrune kugler. Kredit:PNNL Målet med forskningen, of -
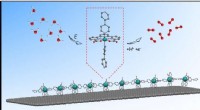 Oligomere materialer for at forbedre vandspaltningOligomer katalysator. Kredit:Marcos Gil-Sepulcre (ICIQ) Forskere fra Llobet-gruppen har udviklet et nyt molekylært materiale lavet af oligomerer og brugt det som en katalysator i vandoxidation, op
Oligomere materialer for at forbedre vandspaltningOligomer katalysator. Kredit:Marcos Gil-Sepulcre (ICIQ) Forskere fra Llobet-gruppen har udviklet et nyt molekylært materiale lavet af oligomerer og brugt det som en katalysator i vandoxidation, op -
 Forskere skaber kunstige katalysatorer inspireret af levende enzymerForskere har opfundet en enzymlignende katalysator fremstillet af bløde polymerer (lilla) og en hård palladiumkerne (lyserød). Ved opvarmning, palladium omdanner kemisk molekyler af ilt og kulilte (gu
Forskere skaber kunstige katalysatorer inspireret af levende enzymerForskere har opfundet en enzymlignende katalysator fremstillet af bløde polymerer (lilla) og en hård palladiumkerne (lyserød). Ved opvarmning, palladium omdanner kemisk molekyler af ilt og kulilte (gu -
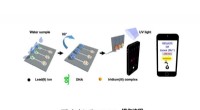 Ny enhed til hurtig og præcis detektering af blyDiagrammet viser detektionsprocessen. Kredit:HKBU Et forskerhold fra Institut for Kemi ved Hong Kong Baptist University (HKBU) har opfundet en bærbar enhed til one-stop-detektion af blykoncentrati
Ny enhed til hurtig og præcis detektering af blyDiagrammet viser detektionsprocessen. Kredit:HKBU Et forskerhold fra Institut for Kemi ved Hong Kong Baptist University (HKBU) har opfundet en bærbar enhed til one-stop-detektion af blykoncentrati
- Hvad er de tre typer multicellulære alger?
- GPS-sporing afslører, hvordan en hunbavian holdt op med at bruge byrummet efter fødslen
- Partikeldetektor hos Fermilab spiller en afgørende rolle i Deep Underground Neutrino Experiment
- Ishavet kan ikke have havis i september, hvis de globale gennemsnitstemperaturer stiger med 2 grader
- En lavtemperatur nanopartikelblæk
- Trykkeriinnovationer giver ti gange forbedring af organisk elektronik


