Hvad er smeltepunkt og kogepunkt?
smeltepunkt og kogepunkt:
smeltepunkt:
* smeltepunktet af et stof er den temperatur, hvormed det overgår fra et fast stof til en flydende tilstand.
* På smeltepunktet findes de faste og flydende faser i ligevægt.
* Denne temperatur er unik for hvert stof og kan bruges til identifikationsformål.
Kogepunkt:
* kogepunkt af et stof er den temperatur, hvormed dets damptryk er lig med det omgivende atmosfæriske tryk.
* Ved denne temperatur ændres væskefasen til en gasformig fase.
* Ligesom smeltepunkt er kogepunktet unikt for hvert stof og kan bruges til identifikation.
Nøgleforskelle:
* faseændring: Meltning involverer en overgang fra fast stof til væske, mens kogning involverer en overgang fra væske til gas.
* Trykafhængighed: Mens smeltepunktet er relativt uafhængigt af tryk, er kogepunktet stærkt afhængig af tryk. Dette er grunden til, at vand koger ved en lavere temperatur i højere højder, hvor atmosfæretrykket er lavere.
* Energiindgang: Meltning kræver mindre energiindgang end kogning, da molekylerne kun behøver at overvinde de intermolekylære kræfter, der holder dem i en solid struktur. Kogning kræver nok energi til at bryde fri fra væskens overfladespænding og flygte ind i gasfasen.
Faktorer, der påvirker smeltning og kogepunkter:
* Intermolekylære kræfter: Stærkere intermolekylære kræfter (f.eks. Hydrogenbinding) fører til højere smelte- og kogepunkter.
* molekylær størrelse og masse: Større molekyler har højere smelte- og kogepunkter på grund af øget overfladeareal og van der Waals -kræfter.
* tryk: Som nævnt tidligere påvirker tryk direkte kogepunktet.
* urenheder: Urenheder kan påvirke både smeltnings- og kogepunkter, og sænker dem ofte.
Ansøgninger:
* Identifikation: Smeltnings- og kogepunkter er vigtige egenskaber, der bruges til at identificere stoffer.
* rensning: Teknikker som fraktioneret destillation bruger forskelle i kogepunkter til separate blandinger.
* Materialvidenskab: Smeltnings- og kogepunkter er afgørende faktorer til bestemmelse af egenskaber og anvendelser af forskellige materialer.
Ved at forstå begreberne smeltnings- og kogepunkter kan vi bedre forstå stoffets opførsel og dets interaktion med dets omgivelser.
 Varme artikler
Varme artikler
-
 Ny belægning bringer lithiummetalbatteri tættere på virkelighedenHovedforfattere og ph.d. studerende David Mackanic, venstre, og Zhiao Yu med deres batteritester til højre. Yu holder et fad med allerede testede celler, som de kalder batterikirkegården. Kredit:Mark
Ny belægning bringer lithiummetalbatteri tættere på virkelighedenHovedforfattere og ph.d. studerende David Mackanic, venstre, og Zhiao Yu med deres batteritester til højre. Yu holder et fad med allerede testede celler, som de kalder batterikirkegården. Kredit:Mark -
 Redesigner håndsprit og donerer 7, 000 gallons til at bekæmpe COVID-19Håndsprit reddet af ethanol. Et velgørende initiativ kørte for at forhindre håndsprit i at løbe kritisk lavt over hele landet. Kredit:Georgia Tech/Christopher Moore Så mange mennesker, Seth Marder
Redesigner håndsprit og donerer 7, 000 gallons til at bekæmpe COVID-19Håndsprit reddet af ethanol. Et velgørende initiativ kørte for at forhindre håndsprit i at løbe kritisk lavt over hele landet. Kredit:Georgia Tech/Christopher Moore Så mange mennesker, Seth Marder -
 Bedre biomassekonvertering til biobrændstoffer og bioprodukterDet organiske opløsningsmiddel GVL opløser biomasse i forskellige sukkerfraktioner (vist her), der kan opgraderes kemisk eller biologisk til biobrændstoffer og bioprodukter. Kredit:MATTHEW WISNIEWSKI,
Bedre biomassekonvertering til biobrændstoffer og bioprodukterDet organiske opløsningsmiddel GVL opløser biomasse i forskellige sukkerfraktioner (vist her), der kan opgraderes kemisk eller biologisk til biobrændstoffer og bioprodukter. Kredit:MATTHEW WISNIEWSKI, -
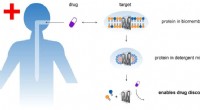 Nye rengøringsmidler til lægemiddelforskningFølsomme proteiner (grå struktur) kan bedre udvindes fra biomembraner ved hjælp af nye sæber. Proteinerne kan derefter studeres i detaljer for deres potentielle anvendelse i nye lægemidler. Kredit:Leo
Nye rengøringsmidler til lægemiddelforskningFølsomme proteiner (grå struktur) kan bedre udvindes fra biomembraner ved hjælp af nye sæber. Proteinerne kan derefter studeres i detaljer for deres potentielle anvendelse i nye lægemidler. Kredit:Leo
- Hvilken slags pladegrænse har Thingvellir National Park?
- Byer skal grønnes for at mindske virkningen af luftforurening
- Farlige vindkulde, sne i Midtvesten; kolde greb Nordøst
- Mangel på offentlig påskønnelse bidrager til ensomhed i landbruget, viser undersøgelse
- Hvorfor kaldes det vaseline, når det er lavet med vaseline og ikke noget olie?
- Verdens rigeste mand Jeff Bezos brager ud i rummet


