Navn 3 -videnskabsmand, der bidrog til den aktuelle viden om atomet og forklare deres bidrag.?
1. J.J. Thomson (1856-1940):
* Bidrag: Opdagede elektronet.
* Eksperiment: Thomson udførte eksperimenter med katodestrålerør. Han observerede, at stråler, der blev udsendt fra katoden, blev afbøjet med elektriske og magnetiske felter, hvilket bevisede, at de bar en negativ ladning. Han konkluderede, at disse stråler var sammensat af negativt ladede partikler, som han navngav elektroner.
* Betydning: Thomsons opdagelse af elektronet revolutionerede forståelsen af atomet. Det viste, at atomer ikke var udelelige, som tidligere antaget, men indeholdt mindre, ladede partikler. Han foreslog modellen "blomme budding", hvor elektroner var indlejret i en positivt ladet sfære.
2. Ernest Rutherford (1871-1937):
* Bidrag: Foreslog atomets nukleare model.
* Eksperiment: Rutherford gennemførte det berømte guldfolieeksperiment. Han fyrede alfa -partikler (positivt ladede partikler) ved et tyndt ark med guldfolie. De fleste af partiklerne passerede lige igennem, men nogle blev afbøjet i store vinkler, og et par endda sprang tilbage.
* Betydning: Rutherfords observationer førte til, at han foreslog, at det meste af atomets masse og positive ladninger var koncentreret i en lille, tæt kerne kaldet kernen. Han teoretiserede, at elektroner kredsede kernen på afstand. Denne model udfordrede Thomsons "Plum Pudding" -model og ændrede grundlæggende vores forståelse af atomstruktur.
3. Niels Bohr (1885-1962):
* Bidrag: Udviklede Bohr -modellen for atomet.
* teori: Bohr kombinerede Rutherfords nukleare model med principperne for kvantemekanik. Han foreslog, at elektroner kredsede om kernen i specifikke, kvantiserede energiniveauer. Elektroner kan kun eksistere i disse diskrete energiniveau og kan hoppe mellem dem ved at absorbere eller udsende energi.
* Betydning: Bohrs model forklarede de spektrale linjer for brint og gav et fundament for forståelse af atomspektre. Det introducerede begrebet kvantiseret energiniveau, der blev afgørende i udviklingen af kvantemekanik.
Disse forskere og deres arbejde byggede på hinanden og raffinerede gradvist vores forståelse af atomet og dets struktur. Deres bidrag er fortsat grundlæggende inden for mange videnskabsområder, herunder kemi, fysik og materialevidenskab.
 Varme artikler
Varme artikler
-
 Nyt membranmateriale fjerner flere urenheder uden behov for giftige opløsningsmidlerMIT-forskere har udviklet en ny polymermembran, der dramatisk kan forbedre effektiviteten af naturgasrensning, samtidig reducere dens miljøpåvirkning. Kredit:Chelsea Turner, MIT Naturgas og biog
Nyt membranmateriale fjerner flere urenheder uden behov for giftige opløsningsmidlerMIT-forskere har udviklet en ny polymermembran, der dramatisk kan forbedre effektiviteten af naturgasrensning, samtidig reducere dens miljøpåvirkning. Kredit:Chelsea Turner, MIT Naturgas og biog -
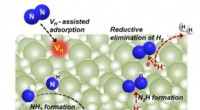 Overgangsmetalfrit bariumhydrid medierer dinitrogenfiksering og ammoniaksynteseOvergangsmetalfri dinitrogenfiksering medieret af bariumhydrid. Kredit:Guan Yeqin Ammoniak er afgørende for fremstillingen af kvælstofgødning. På grund af det høje energiforbrug ved industriel am
Overgangsmetalfrit bariumhydrid medierer dinitrogenfiksering og ammoniaksynteseOvergangsmetalfri dinitrogenfiksering medieret af bariumhydrid. Kredit:Guan Yeqin Ammoniak er afgørende for fremstillingen af kvælstofgødning. På grund af det høje energiforbrug ved industriel am -
 Cryo-EM-strukturer af nikotinreceptoren kan føre til nye terapier for afhængighedTredimensionelle strukturer af nikotinacetylcholinreceptor bestemt af cryo-EM, med tilladelse fra Hibbs Lab. Kredit:Hibbs Lab, UT Southwestern Medical Center UT Southwestern forskere offentliggjor
Cryo-EM-strukturer af nikotinreceptoren kan føre til nye terapier for afhængighedTredimensionelle strukturer af nikotinacetylcholinreceptor bestemt af cryo-EM, med tilladelse fra Hibbs Lab. Kredit:Hibbs Lab, UT Southwestern Medical Center UT Southwestern forskere offentliggjor -
 Polymer muliggør hårdere genanvendelig termoplastKredit:Unsplash/CC0 Public Domain For at syntetisere plastik, små monomermolekyler skal spændes sammen som perler i en halskæde, skabe lange polymerkæder. Imidlertid, ikke alle plastik - eller de
Polymer muliggør hårdere genanvendelig termoplastKredit:Unsplash/CC0 Public Domain For at syntetisere plastik, små monomermolekyler skal spændes sammen som perler i en halskæde, skabe lange polymerkæder. Imidlertid, ikke alle plastik - eller de


