Hvad ville ligevægtskoncentrationen af NO være i en gasblanding, der indeholder 1,7 M SO3 0,070 SO2 og 1,3 NO2, hvis KEQ 10,8 under disse forhold?
1. Skriv den afbalancerede kemiske ligning og ligevægtsudtrykket:
Den afbalancerede kemiske ligning for reaktionen er:
`` `
SO3 (g) + NO (G) ⇌ SO2 (G) + NO2 (G)
`` `
Ligevægtsudtrykket er:
`` `
Keq =([SO2] [NO2]) / ([SO3] [NO])
`` `
2. Opret et isbord:
| | SO3 | Nej | SO2 | NO2 |
| ------- | ------- | ------- | ------- | ------- |
| Indledende | 1,7 m | 0 | 0,070 m | 1,3 m |
| Ændring | -x | -x | +x | +x |
| Equil | 1,7-x | -x | 0,070+x | 1.3+x |
3. Udskift ligevægtskoncentrationerne i ligevægtsudtrykket:
`` `
10,8 =((0,070 + x) (1,3 + x)) / ((1,7 - x) (x))
`` `
4. Løs for x:
Denne ligning er en kvadratisk ligning. Du kan løse den ved hjælp af den kvadratiske formel eller ved at forenkle ligningen og foretage tilnærmelser.
* tilnærmelse: Da KEQ er relativt stor, kan vi antage, at ændringen i koncentration (X) er lille sammenlignet med de indledende koncentrationer af SO3, SO2 og NO2. Dette giver os mulighed for at forenkle ligningen:
`` `
10,8 ≈ (0,070 * 1,3) / (1,7 * x)
`` `
* Løsning til x:
`` `
x ≈ (0,070 * 1,3) / (10,8 * 1,7) ≈ 0,0053 m
`` `
5. Beregn ligevægtskoncentrationen af NO:
`` `
[Nej] =-x ≈ -0,0053 m
`` `
Da koncentrationen ikke kan være negativ, indikerer dette, at vores tilnærmelse ikke var gyldig. Vi er nødt til at løse den fulde kvadratiske ligning.
Løsning af den kvadratiske ligning:
1. Udvid ligningen fra trin 3.
2. Omarranger det til en standard kvadratisk form (Ax² + Bx + C =0).
3. Brug den kvadratiske formel til at løse for x.
Vigtigt: Den kvadratiske formel giver dig to løsninger til x. Du skal vælge den løsning, der giver fysisk mening (dvs. en positiv værdi for [nej]).
Efter løsning af den kvadratiske ligning får du ligevægtskoncentrationen af nr.
Sidste artikelEr egenskaberne ved natrium Na mere som lithium eller magnesium?
Næste artikelHvilke ioner dannes, når KNO3 opløses i vand?
 Varme artikler
Varme artikler
-
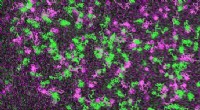 Forskere observerer individuelle cellulære receptorer på arbejdeSamtidig visualisering og sporing af individuelle receptorer (grøn) og G -proteiner (magenta) på overfladen af en levende celle. Receptorerne og G -proteiner gennemgår forbigående interaktioner, som
Forskere observerer individuelle cellulære receptorer på arbejdeSamtidig visualisering og sporing af individuelle receptorer (grøn) og G -proteiner (magenta) på overfladen af en levende celle. Receptorerne og G -proteiner gennemgår forbigående interaktioner, som -
 Alt-afvisende belægning kunne børnesikre telefoner, hjemI et forskud, der kunne snavssikre telefonskærme, bordplader, kameralinser og utallige andre hverdagsting, en materialevidenskabsforsker ved University of Michigan har demonstreret en glat, holdbar, k
Alt-afvisende belægning kunne børnesikre telefoner, hjemI et forskud, der kunne snavssikre telefonskærme, bordplader, kameralinser og utallige andre hverdagsting, en materialevidenskabsforsker ved University of Michigan har demonstreret en glat, holdbar, k -
 En ny måde at fjerne isopbygning uden strøm eller kemikalierFra flyvinger til luftledninger til de gigantiske vinger på vindmøller, en ophobning af is kan forårsage problemer lige fra nedsat ydeevne hele vejen til katastrofale svigt. Men at forhindre den ophob
En ny måde at fjerne isopbygning uden strøm eller kemikalierFra flyvinger til luftledninger til de gigantiske vinger på vindmøller, en ophobning af is kan forårsage problemer lige fra nedsat ydeevne hele vejen til katastrofale svigt. Men at forhindre den ophob -
 Forskere kortlægger giftige proteiner forbundet med AlzheimersRashik Ahmed, hovedforfatter og ph.d.-kandidat i Institut for Biokemi og Biomedicinske Videnskaber og Giuseppe Melacini, seniorforfatter og professor i afdelingerne for kemi og kemisk biologi Kredit:G
Forskere kortlægger giftige proteiner forbundet med AlzheimersRashik Ahmed, hovedforfatter og ph.d.-kandidat i Institut for Biokemi og Biomedicinske Videnskaber og Giuseppe Melacini, seniorforfatter og professor i afdelingerne for kemi og kemisk biologi Kredit:G
- Hvad har variabler og uafhængige til fælles?
- En ny teknik til fremstilling af spændende metaloxidskeletter
- Hvordan bestemmer astronomer overfladetemperaturerne for stjerner?
- Hvordan er Reptiles vigtige for mennesker?
- Hvad gør geologiske eksperter?
- Min mave er vred, min hals er forelsket:Kropsdele og følelser på oprindelige sprog


