Forklar, hvorfor væsker og faste stoffer ikke er komprimerbare?
* Intermolekylære kræfter: Væsker og faste stoffer har stærke intermolekylære kræfter (som brintbindinger, dipol-dipolinteraktioner eller London-spredningskræfter), der holder deres molekyler tæt sammen. Disse kræfter modstår ændringer i volumen.
* densitet: Væsker og faste stoffer har en meget højere densitet sammenlignet med gasser. Dette betyder, at deres molekyler er pakket tættere, hvilket efterlader mindre plads mellem dem.
* Komprimering: Når du lægger pres på en væske eller fast, prøver du i det væsentlige at skubbe molekylerne tættere sammen. Da de allerede er meget tæt, modstår de stærke intermolekylære kræfter denne komprimering.
Her er en mere nøjagtig måde at beskrive det på:
* væsker og faste stoffer er meget mindre komprimerbare end gasser. Dette betyder, at de kræver markant mere pres for at ændre deres volumen sammenlignet med gasser.
Eksempler:
* Vand: Du kan komprimere vand i lille grad, men du har brug for utroligt høje tryk.
* stål: Stål er ekstremt modstandsdygtigt over for komprimering, hvilket gør det til et godt materiale til at bygge broer og skyskrabere.
Key Takeaway: Mens væsker og faste stoffer ofte beskrives som ukomprimerbare, er det vigtigt at huske, at de komprimerer lidt under meget høje tryk. Det centrale punkt er, at deres kompressibilitet er væsentligt mindre end gasser.
Sidste artikelHvem studerer fission og fusion af atomer?
Næste artikelHvad er molariteten på 23 procent N-butyllithium i hexan?
 Varme artikler
Varme artikler
-
 Websted for datadeling kan fremskynde reaktionen på nye ulovlige stofferNPS DataHub giver retsmedicinske kemikere mulighed for at dele data om nye lægemiddelanaloger, herunder deres kemiske strukturer og signaturer, som er nøglerne til at identificere dem i laboratoriet.
Websted for datadeling kan fremskynde reaktionen på nye ulovlige stofferNPS DataHub giver retsmedicinske kemikere mulighed for at dele data om nye lægemiddelanaloger, herunder deres kemiske strukturer og signaturer, som er nøglerne til at identificere dem i laboratoriet. -
 Molekylær sværm omarrangerer overfladestrukturer atom for atomMeget som en lynlås, carbenmolekyler samarbejder på en guldoverflade for at forbinde to rækker af atomer i en række, resulterer - trin for trin - i en ny overfladestruktur. Kredit:Saeed Amirjalayer
Molekylær sværm omarrangerer overfladestrukturer atom for atomMeget som en lynlås, carbenmolekyler samarbejder på en guldoverflade for at forbinde to rækker af atomer i en række, resulterer - trin for trin - i en ny overfladestruktur. Kredit:Saeed Amirjalayer -
 Forskning i retning af levedygtige, sikre batterier overvinder høj modstand, solid-state barrierer …Kredit:A. James Clark School of Engineering, University of Maryland Ingeniører ved University of Maryland har udviklet et middel til at overvinde forhindringer i udviklingen af solid-state batte
Forskning i retning af levedygtige, sikre batterier overvinder høj modstand, solid-state barrierer …Kredit:A. James Clark School of Engineering, University of Maryland Ingeniører ved University of Maryland har udviklet et middel til at overvinde forhindringer i udviklingen af solid-state batte -
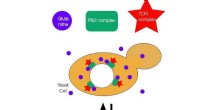 Glutaminafhængig aktivering af cellevækst opdagetFig. 1. TOR -kompleksaktiveringsmekanisme ved Glutamin, der binder til Pib2 -kompleks:Når glutamin er tilgængeligt, cellerne begynder at vokse, mens den ikke er tilgængelig, de starter autofagi. Foror
Glutaminafhængig aktivering af cellevækst opdagetFig. 1. TOR -kompleksaktiveringsmekanisme ved Glutamin, der binder til Pib2 -kompleks:Når glutamin er tilgængeligt, cellerne begynder at vokse, mens den ikke er tilgængelig, de starter autofagi. Foror
- Hvorfor er der mere drivhusgas i atmosfæren, end du måske var klar over
- Hvordan finder man den konsekvens, det sydlige kors?
- Hvilket udsagn beskriver korrekt to former for oxygen O2 og O3?
- Undersøgelse finder meget få sider afsat til klimaændringer i indledende videnskabslærebøger
- NASA sigter mod 13 landingssteder på månernes sydpol for menneskelig landing
- Hvilket brændstof bruges i raketter?


