Hvad sker der med potentialet af molekyler i en reaktion?
1. Reaktanter:
* starttilstand: Reaktantmolekyler har en vis mængde potentiel energi på grund af bindingerne i deres strukturer.
* Aktiveringsenergi: For at starte en reaktion er reaktanterne nødt til at overvinde en energibarriere kaldet aktiveringsenergi . Denne energiindgang leveres ofte af varme eller lys.
2. Overgangstilstand:
* Når reaktanterne får nok energi, når de en overgangstilstand . Dette er en højenergi, ustabil tilstand, hvor de gamle obligationer bryder og nye obligationer dannes.
3. Produkter:
* Endelig tilstand: Reaktionen skrider frem og danner nye produkter med forskellige molekylære strukturer og bindingsarrangementer. Produkternes potentielle energi kan være:
* lavere end reaktanterne: Dette indikerer en eksoterm reaktion , hvor energi frigøres i omgivelserne (f.eks. Brændende brændstof).
* højere end reaktanterne: Dette indikerer en endotermisk reaktion , hvor energi absorberes fra omgivelserne (f.eks. Meltende is).
Her er en visuel analogi:
Forestil dig at skubbe en klippe op ad en bakke.
* Klippen i bunden repræsenterer reaktanterne, og toppen af bakken repræsenterer produkterne.
* Selve bakken er aktiveringsenergibarrieren.
* Handlingen med at skubbe klippen op ad bakke er som at give energien til, at reaktionen kan forekomme.
* Hvis klippen har mindre potentiel energi øverst på bakken (lavere end da den startede), er det som en eksoterm reaktion.
* Hvis klippen har mere potentiel energi øverst (højere end da den startede), er det som en endotermisk reaktion.
Nøglepunkter:
* Ændringen i potentiel energi bestemmer, om en reaktion er eksoterm eller endotermisk.
* Aktiveringsenergien påvirker, hvor let en reaktion kan fortsætte. En lavere aktiveringsenergi betyder, at reaktionen er lettere at starte.
* Katalysatorer kan sænke aktiveringsenergien, hvilket får reaktioner til at ske hurtigere.
Fortæl mig, hvis du gerne vil udforske nogen specifikke typer reaktioner eller gå dybere ned i nogen af disse koncepter!
 Varme artikler
Varme artikler
-
 Syntetiske kulhydrater afværger pneumokokinfektionerSukkerbaseret immunforsvar:nyt, mere effektive vaccinekandidater mod pneumoccoci kan fremstilles ved hjælp af syntetisk kemi. Det mellemprodukt, der er vist her, opstår under produktionen af en kulh
Syntetiske kulhydrater afværger pneumokokinfektionerSukkerbaseret immunforsvar:nyt, mere effektive vaccinekandidater mod pneumoccoci kan fremstilles ved hjælp af syntetisk kemi. Det mellemprodukt, der er vist her, opstår under produktionen af en kulh -
 Retsmedicinsk kemiker bruger sved til at skelne mellem personer på gerningsstedetFra højre:Jan Halámek og eleverne Mindy Hair, Erica Brunelle og Adrianna Mathis. Kredit:University at Albany En gennemsnitlig kvadratcentimeter hud indeholder 650 svedkirtler. Det betyder, at vore
Retsmedicinsk kemiker bruger sved til at skelne mellem personer på gerningsstedetFra højre:Jan Halámek og eleverne Mindy Hair, Erica Brunelle og Adrianna Mathis. Kredit:University at Albany En gennemsnitlig kvadratcentimeter hud indeholder 650 svedkirtler. Det betyder, at vore -
 Fordel:Vand - Forskere løser nøglespørgsmål om titaniumoxid, vand interaktionerNår vand (vist med blåt) kommer ind for en landing på den almindelige katalysator titaniumoxid (vist med rødt og grønt), det deler sig i hydroxyler (på venstre overflade) lige under halvdelen af tid
Fordel:Vand - Forskere løser nøglespørgsmål om titaniumoxid, vand interaktionerNår vand (vist med blåt) kommer ind for en landing på den almindelige katalysator titaniumoxid (vist med rødt og grønt), det deler sig i hydroxyler (på venstre overflade) lige under halvdelen af tid -
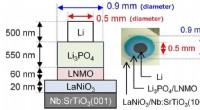 Udvidelse af grænserne for Li-ion-batterier – elektroder til hel-solid-state batterierBatterierne blev fremstillet ved at stable forskellige lag via tynd-film aflejringsmetoder. LNMO/Li 3 PO 4 grænsefladen viste spontan migration af Li-ioner og havde en hidtil uset lav modstand. Kr
Udvidelse af grænserne for Li-ion-batterier – elektroder til hel-solid-state batterierBatterierne blev fremstillet ved at stable forskellige lag via tynd-film aflejringsmetoder. LNMO/Li 3 PO 4 grænsefladen viste spontan migration af Li-ioner og havde en hidtil uset lav modstand. Kr
- Hvad er de tre lyseste stjerner på himlen?
- Hvornår vil videostreaming til køretøjet via satellitradio faktisk forekomme?
- Den proces, hvorved celler nedbryder molekyler for at frigive energi uden at bruge ilt?
- Hvad er forskellen mellem en stjerne og konstellation?
- Concordia -studerende kortlægger globale primathabitater, der er truet af klimaændringer
- Er det godt eller uflaks at se månen om dagen?


