Fordel:Vand - Forskere løser nøglespørgsmål om titaniumoxid, vand interaktioner
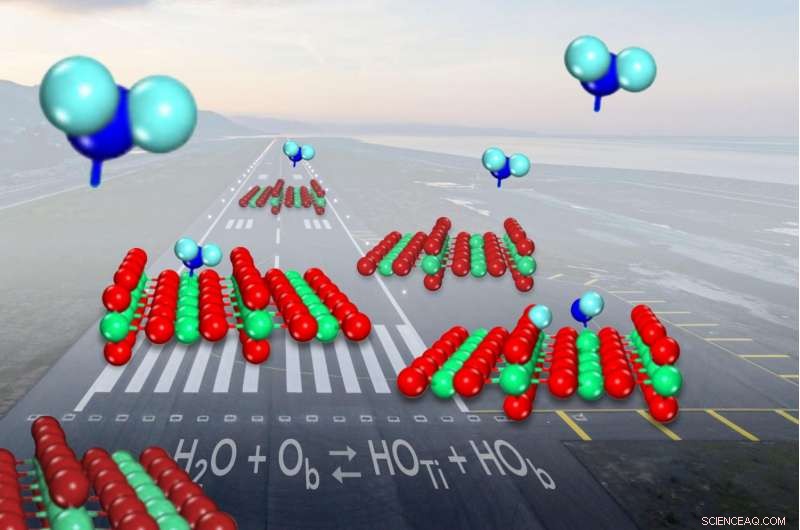
Når vand (vist med blåt) kommer ind for en landing på den almindelige katalysator titaniumoxid (vist med rødt og grønt), det deler sig i hydroxyler (på venstre overflade) lige under halvdelen af tiden. Kredit:Zdenek Dohnalek
Når et molekyle vand kommer ind til en landing på den almindelige katalysator titaniumoxid, det bryder nogle gange op og danner et par molekylefragmenter kendt som hydroxyler. Men forskere havde ikke været i stand til at vise, hvor ofte bruddet skete. Nu, forskere har fastslået, at vand kun er lidt mere tilbøjeligt til at blive i et stykke, da det binder sig til katalysatoroverfladen, end det er at danne hydroxylparene.
Resultatet - vandets fordel er så lille - kan overraske nogle kemikere. Men forståelsen af, at den lille fordel har bred betydning for en række potentielle anvendelser i brancher, der bruger titandioxid. Disse industrier omfatter alternativ brændstofproduktion, solenergi og fødevaresikkerhed, og endda selvrensende vinduer. Det vil også hjælpe forskere med bedre at forstå, hvordan syrer opfører sig og udvide deres viden om, hvordan molekyler deler sig.
"Hvordan vand binder var det store spørgsmål, "sagde kemiker Zdenek Dohnalek ved Department of Energy's Pacific Northwest National Laboratory." Kemikere havde blandet information fra en masse forskellige metoder, og teoretikere havde også ideer. Ved hjælp af en unik kombination af instrumenter, vi har endelig løst det. "
Teamet rapporterede arbejdet i Procedurer fra National Academy of Sciences .
Mysteriets land
Selvom mange industrier bruger titaniumoxid til at fremskynde kemiske reaktioner, forskere har ikke afsløret alle dens hemmeligheder. Et centralt mysterium, forskere har længe diskuteret, er den måde, hvorpå vand interagerer med titaniumoxid. Samspillet er vigtigt i sig selv for at splitte vand, men det påvirker også forløbet af mange reaktioner generelt.
På overfladen af titanoxid, vandmolekyler skifter mellem at være intakte og opdeling i hydroxyler. Selvom der til enhver tid er mange forskellige måder at måle forholdet mellem intakt vand og hydroxyler på, forskere har ikke været i stand til at sømme det ned i årtier.
For at undersøge problemet, PNNL -forskere kombinerede forskellige værktøjer på en ny måde. De sendte vandstråler med forskellige hastigheder over på koldt titaniumoxid, der sad under et mikroskop med meget høj opløsning, kendt som et scannende tunnelmikroskop.
Mikroskopet lod dem visualisere katalysatorens titan- og iltatomer. Atomer fremstår som lyse og mørke rækker, som en kornmark med høje majsrækker, der veksler med grøfter, og individuelle vandmolekyler fremstår som lyspunkter, der ikke stemmer overens med rækkerne.
Ud over at se vandmolekyler, når de rammer overfladen, teamet simulerede detaljer om atomer, der interagerede i præcise detaljer på en computer med høj ydeevne. Kombination af eksperimenter og simuleringer gav teamet mulighed for at afvikle den mangeårige debat.
Øjeblikkelig tiltrækning
Formet som et V, et vandmolekyle har et fedt oxygenatom i midten bundet til to mindre brintatomer på hver side. Titaniumoxid hjælper med at bryde bindingerne mellem atomerne for at skubbe en kemisk reaktion fremad:titanatomerne fanger vandmolekyler, mens oxygens i nærheden, også en del af katalysatoroverfladen, trækker væk og indfanger derefter et af brintatomerne.
Når dette sker, to hydroxyler dannes, den ene fra en overflade oxygen, der kombineres med hydrogenet og den anden rest fra vandmolekylet.
Forskerne havde brug for at vide, hvor ofte hydroxylerne dannede. Bliver vandmolekyler stort set intakte på overfladen? Eller konverterer de straks til hydroxyler? Hvor sandsynligt vand vil forblive intakt på titaniumoxid - og hvor let hydroxylerne omdannes til vand - sætter scenen for andre kemiske reaktioner.
At finde ud af, kemikerne måtte udvikle teknologier til at måle, hvor ofte hydroxylerne opstod på overfladen. Ved hjælp af ressourcer udviklet inden for EMSL, Environmental Molecular Sciences Laboratory, en DOE Office of Science User Facility på PNNL, de skød en stråle vandmolekyler mod en titaniumoxidoverflade ved lav energi - strålen skyder langsomt, og ved høj energi - bevæger sig hurtigt som ud af en ildslange.
De endte med lyspunkter på overfladen, og jo højere energi, de flere pletter. Men pletterne så ikke lyse nok ud til at omfatte begge hydroxyler, som forventet, så de udførte yderligere forsøg for at bestemme, hvad pletterne var.
Nøjagtigt
Holdet skød vand på titandioxidoverfladen og frøs derefter vandet på plads. Derefter varmede de langsomt alt op. Høj temperatur viste, at pletterne - som de troede var mindst et hydroxyl - ændrede sig til vandmolekyler. Dette betød, at hver plet faktisk skulle være et par hydroxyler, fordi beviserne viste, at alle de råvarer, der var nødvendige for at lave et vandmolekyle, sad der, og begge hydroxyler var nødvendige.
De udførte forskellige andre forsøg for at bestemme den temperatur, ved hvilken et landingsvandsmolekyle omdannes til hydroxylpar og omvendt. Derfra lærte de, at vand kun er lidt mere stabilt end hydroxylparene på overfladen - 10 procent mere, hvis vi går efter den mængde energi, det tager at forstyrre dem.
Simulering af vandlandinger på en computer med høj ydeevne, også på EMSL, forskerne fandt ud af, at de eneste vandmolekyler, der holdt fast ved katalysatoren, var dem, der landede i en figurativ grøft inden for en kornmark, hvor vandets ilt stod over for et titaniumatom nede i grøften.
Hvis vandet kom ind med den helt rigtige hastighed, vandet omorienterede og lagde et af dets hydrogener til en ilt i nærheden, dannelse af hydroxylparene set i eksperimenterne. Hvis ikke, vandmolekylet hoppede lige af.
"Vi opdagede, at elektrostatik - den samme statiske, der giver gnister, når du gnider dine fødder på gulvtæppet - hjalp med at styre vandmolekylerne på overfladen, "sagde den teoretiske kemiker og medforfatter Roger Rousseau.
Alle disse detaljer vil hjælpe forskere med at forstå katalyse bedre og forbedre vores forståelse af kemiske reaktioner. Ud over, resultaterne afslører en værdi, som forskere længe har forsøgt at sømme - hvor let eller svært det er for vand at miste et brint på titaniumoxid.
 Varme artikler
Varme artikler
-
 Struktur af større hjernereceptor, der er behandlingsmål for epilepsi, angst løstArkitekturen af GABAA-receptoren. Kredit:UT Southwestern UT Southwestern-forskere har i dag offentliggjort den første atomare struktur af en hjernereceptor bundet til et lægemiddel, der bruges t
Struktur af større hjernereceptor, der er behandlingsmål for epilepsi, angst løstArkitekturen af GABAA-receptoren. Kredit:UT Southwestern UT Southwestern-forskere har i dag offentliggjort den første atomare struktur af en hjernereceptor bundet til et lægemiddel, der bruges t -
 Undersøgelse finder beviser for eksistensen af undvigende metabolonKredit:CC0 Public Domain I mere end 40 år, videnskabsmænd har antaget eksistensen af enzymklynger, eller metaboloner, ved at lette forskellige processer i celler. Ved hjælp af en ny billedtekno
Undersøgelse finder beviser for eksistensen af undvigende metabolonKredit:CC0 Public Domain I mere end 40 år, videnskabsmænd har antaget eksistensen af enzymklynger, eller metaboloner, ved at lette forskellige processer i celler. Ved hjælp af en ny billedtekno -
 Sådan beregnes pakningsfraktionen af et diamantgitterAtomer inden for faste stoffer er arrangeret i en af flere periodiske strukturer kendt som et gitter. Krystallinske strukturer, i modsætning til amorfe strukturer, viser et bestemt gentaget mønst
Sådan beregnes pakningsfraktionen af et diamantgitterAtomer inden for faste stoffer er arrangeret i en af flere periodiske strukturer kendt som et gitter. Krystallinske strukturer, i modsætning til amorfe strukturer, viser et bestemt gentaget mønst -
 Et eksempel på plasmoner, der direkte påvirker molekylerExcitationsmekanismer for plasmoninducerede kemiske reaktioner. (A) indirekte hot-elektron overførsel mekanisme. Varme elektroner (e−) genereret via ikke -strålende henfald af en LSP overført til dann
Et eksempel på plasmoner, der direkte påvirker molekylerExcitationsmekanismer for plasmoninducerede kemiske reaktioner. (A) indirekte hot-elektron overførsel mekanisme. Varme elektroner (e−) genereret via ikke -strålende henfald af en LSP overført til dann
- NASA fanger Tropical Cyclone Gajas landfall
- Statusopdatering:OSIRIS-REx Osprey Flyover
- Ingen anden chance for at gøre et tillidsfuldt første indtryk, eller er der?
- Nanocages letter dramatisk strukturdannelsen af biomolekyler
- Undersøgelse:Kunstnerisk anerkendelse afhænger af en signaturstil eller outputtempoet
- Materiale, der ligner en metal nanosvamp, kan reducere computerens energiforbrug til et minimum


