Hvad er ækvivalenspunktet i en syrebasreaktion?
Her er en sammenbrud:
* syre-base-reaktion: I en syre-base-reaktion reagerer en syre (H⁺-donor) med en base (OH⁻-acceptor) for at danne salt og vand.
* ækvivalenspunkt: På ækvivalenspunktet er mængden af syre og base støkiometrisk lige. Dette betyder, at al syre har reageret med al basis, og omvendt.
* neutralisering: Ekvivalenspunktet betegner fuldstændig neutralisering, hvor opløsningens pH bestemmes af det dannede salt. Hvis saltet er fra en stærk syre og stærk base, vil pH være neutral (7). Hvis saltet er fra en svag syre og stærk base, vil pH være lidt grundlæggende, og vice versa.
Vigtige noter:
* ækvivalenspunkt vs. slutpunkt: Ekvivalenspunktet er et teoretisk koncept, mens slutpunktet er det punkt, hvor en indikator ændrer farve, der signaliserer gennemførelsen af reaktionen. Slutpunktet skal ideelt set falde sammen med ækvivalenspunktet, men der kan være en lille forskel på grund af indikatorbegrænsninger.
* titrering: Ekvivalenspunktet bestemmes ofte i titreringer, hvor en opløsning af kendt koncentration (titrant) tilsættes til en opløsning af ukendt koncentration (analyt), indtil ækvivalenspunktet er nået.
Eksempel:
Overvej titreringen af en stærk syre (HCI) med en stærk base (NaOH):
`` `
HCL (aq) + NaOH (aq) → NaCl (aq) + h₂o (l)
`` `
På ækvivalenspunktet vil molen af HCI være lig med molen af NaOH. Den resulterende opløsning vil kun indeholde NaCl (salt) og vand, og pH vil være neutral (7).
 Varme artikler
Varme artikler
-
 Ny indsigt i strukturen af et dræberproteinStephanie Bleicken (til venstre), Enrica Bordignon, og Tufa Assafa undersøgte proteinet ved hjælp af forskellige spektroskopiske teknikker. Kredit:RUB, Kramer Forskere ved Ruhr-Universität Bochum
Ny indsigt i strukturen af et dræberproteinStephanie Bleicken (til venstre), Enrica Bordignon, og Tufa Assafa undersøgte proteinet ved hjælp af forskellige spektroskopiske teknikker. Kredit:RUB, Kramer Forskere ved Ruhr-Universität Bochum -
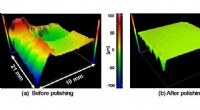 Gør en-krystal diamant klar til elektronikForm af mosaik-enkeltkrystal diamantsubstrat før og efter plasma-assisteret polering. Kredit:Osaka University Silicium har været elektronikkens arbejdshest i årtier, fordi det er et almindeligt el
Gør en-krystal diamant klar til elektronikForm af mosaik-enkeltkrystal diamantsubstrat før og efter plasma-assisteret polering. Kredit:Osaka University Silicium har været elektronikkens arbejdshest i årtier, fordi det er et almindeligt el -
 En ny metode til uafbrudt overvågning af faststofformalereaktionerDr. Stipe Lukin, Ruđer Bošković Instituttet. Kredit:Ruđer Bošković Institute Et hold af kemikere fra det kroatiske Ruđer Bošković Institut (RBI) beskrev en ny, letanvendelig metode til uafbrudt ov
En ny metode til uafbrudt overvågning af faststofformalereaktionerDr. Stipe Lukin, Ruđer Bošković Instituttet. Kredit:Ruđer Bošković Institute Et hold af kemikere fra det kroatiske Ruđer Bošković Institut (RBI) beskrev en ny, letanvendelig metode til uafbrudt ov -
 Intelligent genvinding og genbrug af balsatræOmkring 20 procent af elektriciteten i Tyskland blev produceret af vindmøller i 2018. Kredit:Hans-Peter Merten/MATOfoto Der er 30, 000 vindmøller i drift i Tyskland, hvoraf mange begynder at ældes
Intelligent genvinding og genbrug af balsatræOmkring 20 procent af elektriciteten i Tyskland blev produceret af vindmøller i 2018. Kredit:Hans-Peter Merten/MATOfoto Der er 30, 000 vindmøller i drift i Tyskland, hvoraf mange begynder at ældes
- Daimler CEO Dieter Zetsche forlader i 2019
- Facebook blokerer det Iran-forbundne bud på at påvirke USA, Britisk politik
- Video:NASA'er sender raketter
- Hvilken type grænse forekommer i det nye havbund?
- Ny NASA-model finder jordskredstrusler i næsten realtid under kraftige regnskyl
- Hvor målbar er online annoncering?


