Hvad er nedbrydningen af CUSO4?
1. Termisk nedbrydning:
* ved moderate temperaturer (omkring 200 ° C): Cuso 4 Mister vand af krystallisation, drejer fra blå krystaller (cuso 4 · 5H 2 O) til et hvidt pulver (vandfri cuso 4 ):
Cuso 4 · 5H 2 O → Cuso 4 + 5H 2 O
* ved højere temperaturer (over 650 ° C): Vandfri cuso 4 Yderligere nedbrydes til kobber (II) oxid (CUO), svovltrioxid (så 3 ) og iltgas:
2Cuso 4 → 2CUO + 2SO 3 + O 2
2. Elektrolyse:
* I en elektrolytisk celle med kobberelektroder og en opløsning af CUSO 4 , Følgende reaktioner forekommer:
* anode (oxidation): Cu → Cu 2+ + 2e -
* katode (reduktion): Cu 2+ + 2e - → Cu
Dette resulterer i overførsel af kobberioner fra anoden til katoden, hvilket effektivt nedbrydes CUSO 4 .
3. Reaktion med andre stoffer:
* Cuso 4 Kan reagere med forskellige stoffer for at danne forskellige produkter, hvilket effektivt "nedbryder" det i processen. For eksempel:
* reaktion med NaOH: Cuso 4 + 2NAOH → CU (OH) 2 + NA 2 Så 4
* reaktion med bacl 2 : Cuso 4 + BACL 2 → Baso 4 + CUCL 2
Kortfattet: Nedbrydningen af CUSO 4 kan forekomme gennem forskellige veje afhængigt af de involverede forhold og reagenser. De mest almindelige er termisk nedbrydning, som fører til dannelse af kobberoxid og svovltrioxid og elektrolyse, hvilket resulterer i overførsel af kobberioner.
 Varme artikler
Varme artikler
-
 Påvisning af metabolitter på tæt holdKAUST-forskere har udviklet en biosensor, der kan tilpasses i en transistorkonfiguration i mikronskala for at detektere enhver metabolit af interesse. Kredit:2018 KAUST Et nyt koncept for en biose
Påvisning af metabolitter på tæt holdKAUST-forskere har udviklet en biosensor, der kan tilpasses i en transistorkonfiguration i mikronskala for at detektere enhver metabolit af interesse. Kredit:2018 KAUST Et nyt koncept for en biose -
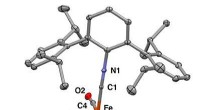 Ustabile molekyleklik med syntetisk strategiRøntgenkrystalstruktur af det mononukleære jern η2-diphosphorkompleks. Kredit:Figueroa Lab Group, UC San Diego / Curtis Moore, Ohio State University Grundstofferne i det periodiske system af grunds
Ustabile molekyleklik med syntetisk strategiRøntgenkrystalstruktur af det mononukleære jern η2-diphosphorkompleks. Kredit:Figueroa Lab Group, UC San Diego / Curtis Moore, Ohio State University Grundstofferne i det periodiske system af grunds -
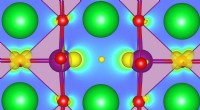 Forskere forbedrer beskrivelsen af defekte oxider med beregning af første principperAt forstå, hvordan defekter kan påvirke grundtilstandsegenskaber, fremme faseovergange, eller muliggøre helt nye funktionaliteter i nogle stærkt korrelerede oxider er blevet et emne af stor interesse
Forskere forbedrer beskrivelsen af defekte oxider med beregning af første principperAt forstå, hvordan defekter kan påvirke grundtilstandsegenskaber, fremme faseovergange, eller muliggøre helt nye funktionaliteter i nogle stærkt korrelerede oxider er blevet et emne af stor interesse -
 Grønnere, hurtigere og billigere måde at lave mønstrede metaller til solceller og elektronikAlle tre forskere fra venstre mod højre:Dr. Ross Hatton, Dr Silva Varagnolo og Dr. Jaemin Lee. Kredit:University of Warwick En innovativ måde at mønstre metaller er blevet opdaget af forskere ved
Grønnere, hurtigere og billigere måde at lave mønstrede metaller til solceller og elektronikAlle tre forskere fra venstre mod højre:Dr. Ross Hatton, Dr Silva Varagnolo og Dr. Jaemin Lee. Kredit:University of Warwick En innovativ måde at mønstre metaller er blevet opdaget af forskere ved
- Forskere bulldozerer ørken for at lære, hvordan klitter dannes
- Magnetisk med en knivspids brint:Forskerhold udvikler ny idé til at forbedre egenskaberne af ultrat…
- Hvor ofte forekommer moonquakes?
- Varmeenergi måles i enheder af hvad?
- NASA får øje på tyfonen Fengshen
- Kulturelle variabler påvirker forbrugernes efterspørgsel efter private label-mærker


